NK bunka
NK bunky (iné názvy: NK-bunky, bunky NK; skr. NKC – z angl. natural killer cells, čiže prirodzené zabíjačské bunky) sú bunky prirodzenej imunity schopné rozpoznať a zlikvidovať predovšetkým nádorové a vírusom infikované bunky. Z morfologického hľadiska sú zaraďované medzi veľké granulárne lymfocyty, na rozdiel od ostatných lymfocytov však nemajú antigénne špecifické receptory a ich typickým povrchovým znakom je prítomnosť receptoru CD16. Aktivita NK buniek je daná súčtom signálov sprostredkovaných ich aktivačnými a inhibičnými receptormi. NK bunky sú funkciou a nástrojmi cytotoxicity podobné cytotoxickým T-lymfocytom, odlišujú sa však od nich spôsobom aktivácie. V každom jedincovi sa nachádza viacero klonov NK buniek líšiacich sa mierou expresie a kombináciou jednotlivých receptorov. [1]
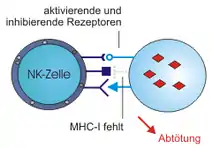
Receptory NK buniek
Pre reaktivitu NK buniek sú potrebné povrchové receptory (NK receptory), ktoré na základe funkcie rozdeľujeme na tzv. aktivačné (pozitívne) a inhibičné (negatívne). Obe tieto skupiny z hľadiska molekulárnej stavby obsahujú imunoglobulínové (u ľudí) a C-lektínové receptory (u myší).[1]
Aktivačné receptory
Aktivačné receptory rozoznávajú predovšetkým proteíny vystavované na povrchu buniek v dôsledku bunkového stresu, akými sú niektoré vírusové proteíny a proteíny, ktorých expresia sa zvyšuje pri infekcii bunky alebo pri jej nádorovej transformácii, ale napríklad aj niektoré typy MHC glykoproteínov. Typickým aktivačným receptorom je Fc receptor CD16 (FcγRIII), ktorý aktivuje cytotoxickú odpoveď namierenú proti bunkám opsonizovaným protilátkami triedy IgG. Tento typ reakcie NK buniek sa nazýva cytotoxická reakcia závislá na protilátkach (ADCC, z angl. antibody-dependent cellular cytotoxicity). Iné známe aktivačné receptory patria do skupiny prirodzených cytotoxických receptorov (NCR, z angl. natural cytotoxicity receptors), ktoré rozpoznávajú širokú škálu membránových aj rozpustných ligandov. Ďalšie známe aktivačné receptory sú homodimer Ly49 a heterodimer CD94 : NKG2, oba patriace do rodiny C-lektínových receptorov (angl. C-type lectin family receptors).[2]
Inhibičné receptory
Inhibičné receptory po naviazaní ligandu blokujú aktiváciu cytotoxickej odpovede NK buniek. Väčšina z nich rozpoznáva MHC glykoproteíny I (MHC gp I), ktorých množstvo je výrazne znížené na nádorových a niektorých vírusom infikovaných bunkách. V tom spočíva aj najpravdepodobnejší evolučný význam NK buniek – cytotoxické T-lymfocyty síce tiež reagujú na nádorové a vírusmi infikované bunky, no práve rozpoznávaním antigénov vystavených na MHC gp I. Ak majú cieľové bunky zníženú expresiu MHC gp I, cytotoxické T-lymfocyty ich nedokážu rozpoznať, no dokážu ich rozpoznať NK bunky, ktoré takto môžu byť aj aktivované vďaka nedostatočnému inhibičnému signálu (tzv. "missing-self" hypotéza). Ďalšia skupina inhibičných receptorov sú leukocytárne inhibičné receptory (LIR) so štruktúrou imunoglobulínového typu.[2]
Cytotoxická odpoveď
Cytotoxické mechanizmy NK buniek sú spustené, ak nad inhibičnými signálmi prevážia aktivačné. Tieto mechanizmy sú totožné s mechanizmami cytotoxických T-lymfocytov. Hlavným mechanizmom je tzv. degranulácia, pri ktorej dochádza k transportu cytotoxických granulí NK buniek ku styčnému povrchu s cieľovou bunkou a následnej fúzii cytoplazmatickej membrány NK bunky s membránou granúl a vyliatiu obsahu granúl do priestoru medzi NK bunku a cieľovú bunku. Granuly obsahujú enzým perforín, ktorý vytvára póry v membráne cieľovej bunky, čím spôsobuje osmotickú lýzu a umožňuje vstup ďalšieho obsahu granúl (proteázy granzýmy) do cieľovej bunky. Granzýmy štiepia prekurzory ďalších proteáz, tzv. kaspáz, čo vedie ku ich aktivácii a zapnutiu kaskády dejov, ktoré vedú k apoptóze cieľovej bunky. Ďalším dôležitým cytotoxickým mechanizmom je indukcia apoptózy cez povrchový proteín NK buniek Fas-ligand (FasL), ktorý väzbou na Fas receptor aktivuje bunkovú kaskádu vedúcu takisto k apoptickej smrti cieľovej bunky.[1]
Regulačné účinky NK buniek
NK bunky hrajú okrem zabíjania cieľových buniek dôležitú rolu v regulácii ostatných súčastí imunity. Aktivované NK bunky produkujú IFNγ, ktorý aktivuje cytotoxickú odpoveď makrofágov a je jedným z faktorov regulujúcich vznik imunitnej reakcie typu Th1. Ďalšie produkované proteíny majú prozápalové (TNFα) a imunosupresívne (interleukín IL-10) účinky.[3][4]
NK bunky a nádory
NK bunky majú dôležitú úlohu v kontrole a indukcie apoptózy malignovaných buniek. U nádorových a stresovaných buniek často dochádza k alterácii expresie MHC molekúl. NK bunky tieto zmeny rozpoznávajú svojimi aktivačnými a inhibičnými receptormi a sú schopné okamžitej imunitnej odpovedi bez predošlej aktivácie ligandom (neobsahujú antigén špecifické receptory). Detekcia nádorových buniek NK bunkami vyústi v cytotoxickú odpoveď a produkciu cytokínov.
V protinádorovej imunitnej odpovedi, NK bunky produkujú prozápalové cytokíny ako Tumor Nekrotizujúci Faktor α (TNFα) a Interferón γ (IFNγ).[4] Detekcia nádorových buniek je mediovaná cez aktivačné receptory ako NKG2D, NKp44, NKp46, NKp30 a inhibičné receptory KIR, Ly49.[5][6]
NK bunky exprimujú Fc receptorové molekuly (FC-gamma-RIII = CD16), viažu Fc časť protilátok, a tak indukujú lýzu buniek cez mehcanizmus nazývaný Cytotoxicita závislá od protilátky (ADCC).[7]
Nádorové bunky su schopné “ujsť” cytotoxickej odpovedi NK buniek produkciou solubilných ligandov pre NKG2D receptory. Dochádza ku kompetícii rozpustných a membránových ligandov a k blokovaniu aktivačných receptorov NK buniek. Táto metóda úniku nádorových buniek pred imunitnou odpoveďou bola detegovaná u nádorov prostaty.[8]
Protinádorová terapia
Chimerický antigénny receptor je geneticky upravený receptor u T buniek, ktorý špecificky cieli na konkrétny proteín. Tieto receptory sú pripravené tak, aby viazali konkrétny antigén a zároveň spustili signalizáčnú odpoveď v bunke. Na podobnom princípe sa dnes vyvíjajú i NK bunkové línie.[9] Fúziou NK aktivačného receptoru NKG2D a Fc časti sa podarilo pripraviť NK bunky, ktoré v imunokompromitovanom myšom modele s lymfómom z EBV vírusovej infekcie spomalili rast tumoru a predĺžili celkové prežitie myší.[10]
Referencie
- HOŘEJŠÍ, Václav a kol. Základy imunologie. 5. vyd. Praha : TRITON, 2013. ISBN 978-80-7387-713-2. Kapitola 11, s. 154 – 156. (po česky)
- BELLORA, Francesca et al.. Human NK cells and NK receptors. Immunology letters, 2013, s. 168 – 173. Dostupné online. DOI: 10.1016/j.imlet.2013.12.009. (anglicky)
- ASHKAR, Ali A.; James P. Di Santo; B. Anne Croy. Interferon γ Contributes to Initiation of Uterine Vascular Modification, Decidual Integrity, and Uterine Natural Killer Cell Maturation during Normal Murine Pregnancy. The Journal of Experimental Medicine, 2000-07-17, s. 259 – 270. Dostupné online [cit. 2014-11-04]. ISSN 0022-1007. DOI: 10.1084/jem.192.2.259. PMID 10899912.
- WANG, Ruipeng; JAW, Jessica J.; STUTZMAN, Nicole C.. Natural killer cell-produced IFN-γ and TNF-α induce target cell cytolysis through up-regulation of ICAM-1. Journal of Leukocyte Biology, 2012 – 2, roč. 91, čís. 2, s. 299 – 309. PMID 22045868 PMCID: PMC3290424. Dostupné online [cit. 2019-06-18]. ISSN 1938-3673. DOI: 10.1189/jlb.0611308.
- LONG, Eric O. Tumor cell recognition by natural killer cells. Seminars in Cancer Biology, 2002 – 02, roč. 12, čís. 1, s. 57 – 61. Dostupné online [cit. 2019-06-18]. ISSN 1044-579X. DOI: 10.1006/scbi.2001.0398.
- VIVIER, E. COLONNA, M. (MARCO), M.D.. Immunobiology of natural killer cell receptors. [s.l.] : Springer, 2006. Dostupné online. ISBN 9783540277439.
- JI, Tianjiao; LANG, Jiayan; NING, Bo. Enhanced Natural Killer Cell Immunotherapy by Rationally Assembling Fc Fragments of Antibodies onto Tumor Membranes. Advanced Materials, 2018-12-14, s. 1804395. Dostupné online [cit. 2019-06-18]. ISSN 0935-9648. DOI: 10.1002/adma.201804395.
- LUNDHOLM, Marie; SCHRÖDER, Mona; NAGAEVA, Olga. Prostate tumor-derived exosomes down-regulate NKG2D expression on natural killer cells and CD8+ T cells: mechanism of immune evasion. PloS One, 2014, roč. 9, čís. 9, s. e108925. PMID 25268476 PMCID: PMC4182531. Dostupné online [cit. 2019-06-18]. ISSN 1932-6203. DOI: 10.1371/journal.pone.0108925.
- BOLLINO, Dominique; WEBB, Tonya J.. Chimeric antigen receptor–engineered natural killer and natural killer T cells for cancer immunotherapy. Translational Research, 2017 – 09, roč. 187, s. 32 – 43. Dostupné online [cit. 2019-06-30]. ISSN 1931-5244. DOI: 10.1016/j.trsl.2017.06.003.
- STEINBACHER, Julia; BALTZ-GHAHREMANPOUR, Katrin; SCHMIEDEL, Benjamin Joachim. An Fc-optimized NKG2D-immunoglobulin G fusion protein for induction of natural killer cell reactivity against leukemia. International Journal of Cancer, 2014-07-28, roč. 136, čís. 5, s. 1073 – 1084. Dostupné online [cit. 2019-06-30]. ISSN 0020-7136. DOI: 10.1002/ijc.29083.