Kyselina etyléndiamínotetraoctová
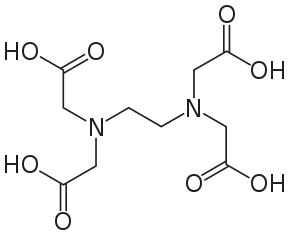
Kyselina etyléndiamíntetraoctová (EDTA, IUPAC: 2-[2-[bis(carboxymethyl)amino]ethyl-(carboxymethyl)amino]acetic acid) je polyaminokarboxylová kyselina s chemickým vzorcom ((CH2)2N2(CH2COOH)4. Kyselina etyléndiamíntetraoctová je vo vode len málo rozpustná (20 mg/100 ml), dobre rozpustná je jej disodná soľ ((CH2)2N2(CH2COOH)2(CH2COONa)2) (10 g/100 ml), výborne rozpustná tetrasodná soľ ((CH2)2N2(CH2COONa)4) (110 g/100 ml) a celý rad iných solí (Mn2+, Zn2+, Fe3+, Cu2+, Ca2+) používaných vo hnojivách (mikronutrienty). Sodnovápenatá soľ kyseliny etyléndiamíntetraoctovej ((CH2)2N2[Ca(CH2COO)2](CH2COONa)2) sa používa aj ako prídavná látka v potravinách E385.
| Kyselina etyléndiamínotetraoctová | |||||||||||||||||||||||||||||||||||
 Kyselina etyléndiamínotetraoctová | |||||||||||||||||||||||||||||||||||
 Kyselina etyléndiamínotetraoctová | |||||||||||||||||||||||||||||||||||
| Všeobecné vlastnosti | |||||||||||||||||||||||||||||||||||
| Sumárny vzorec | ((CH2)2N2(CH2COOH)4), (C10H16N2O8) | ||||||||||||||||||||||||||||||||||
| Vzhľad | Bezfarebná kryštalická látka | ||||||||||||||||||||||||||||||||||
| Fyzikálne vlastnosti | |||||||||||||||||||||||||||||||||||
| Molekulová hmotnosť | 292,2 u | ||||||||||||||||||||||||||||||||||
| Molárna hmotnosť | 292,24264 g/mol | ||||||||||||||||||||||||||||||||||
| Teplota topenia | 245 °C | ||||||||||||||||||||||||||||||||||
| Hustota | 0,86 g/cm3 | ||||||||||||||||||||||||||||||||||
| Rozpustnosť | vo vode: 20 mg/100 ml (20 °C) | ||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| Ďalšie informácie | |||||||||||||||||||||||||||||||||||
| Číslo CAS | 62-33-9 | ||||||||||||||||||||||||||||||||||
| Číslo UN | 3077 | ||||||||||||||||||||||||||||||||||
| EINECS číslo | 23200-449-4 | ||||||||||||||||||||||||||||||||||
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |||||||||||||||||||||||||||||||||||
-ion.png.webp)
Syntéza
Ročná svetová výroba kyseliny etyléndiamíntetraoctovej je okolo 80 000 ton. Vyrába sa reakciou etyléndiamínu s formaldehydom a kyanidom sodným
- NH2(CH2)2NH2 + 4 CH2O + 4 NaCN + 4 H2O → (CH2)2N2(CH2COONa)4 + 4 NH3
- (CH2)2N2(CH2COONa)4 + 4 HCl → (CH2)2N2(CH2COOH)4 + 4 NaCl
Využitie
Kyselina etyléndiamíntetraoctová patrí medzi chelačné činidlá, čo v praxi znamená, že je schopná vytvárať komplexné zlúčeniny - cheláty s iónmi kovov. Toho sa využíva napríklad pri odstraňovaní tvrdosti vody, čo je hojne využívané v pracích a umývacích prostriedkoch. Vápenaté katióny (Ca2+) sú zaviazané do chelátu a neznižujú tak účinnosť umývacieho procesu, čo sa inak deje vo veľkej miere). Takto chelátovaná tvrdosť vody je navyše dobre rozpustná a nedochádza tak k usadzovaniu.
Kyselina etyléndiamíntetraoctová je tiež masovo používaná v papierenskom priemysle pri bezchlórovom bielení buničiny, kde viazaním polyvalentných katiónov (obzvlášť železitého (Fe3+)) stabilizuje peroxid používaný na bielenie a výrazne tak podporuje účinnosť procesu (železitý katión inak spôsobuje katalytický rozklad peroxidov).
Oxidačné vlastnosti etyléndiamíntetraoctanu železitého sú tiež využívané vo fotografii, kde sa používa na rozpúšťanie iónov striebra. Je dôležitou zložkou vo fotografickom priemysle ako oxidačné činidlo vo farebných vývojkách. Jej chelačné schopnosti sa využívajú aj v bunkovej biológii - je schopná rozrušiť bunkové spoje vyžadujúce prítomnosť iónov vápnika. V molekulárnej biológii sa využíva ako súčasť radu pufrov, napríklad TE pufru pre uchovanie DNA, v ktorých zabezpečuje sekvestráciu (chelátovanie) dvojväzobných iónov, ktoré sú nevyhnutné pre funkciu DNázy, čím bráni degradácii DNA.
V medicíne sa kyselina etyléndiamíntetraoctová využíva pri chelačnej terapii, v ktorej slúži na odstránenie ťažkých kovov z tela.
V poslednej dobe sa stále viac rieši neveľmi dobrá biodegradabilita kyseliny etyléndiamíntetraoctovej, ktorá vedie k hľadaniu biologicky lepšie rozložiteľných alternatív.
Externé odkazy
- Lanigan RS, Yamarik TA. Final report on the safety assessment of EDTA, calcium disodium EDTA, diammonium EDTA, dipotassium EDTA, disodium EDTA, TEA-EDTA, tetrasodium EDTA, tripotassium EDTA, trisodium EDTA, HEDTA, and trisodium HEDTA. Int. J. Toxicol., 2002, roč. 21 Suppl 2, s. 95–142. DOI: 10.1080/10915810290096522. PMID 12396676.
- PH-Spectrum of EDTA complexes
- EDTA: Molecule of the Month
- EDTA Determination of Total Water Hardness
- 507 references regarding oral EDTA
- EDTA: the chelating agent under environmental scrutin, Química Nova, Nov.-Dec., 2003 (text version)
- EDTA: the chelating agent under environmental scrutin, Química Nova, Nov.-Dec., 2003 (PDF verzia)
Zdroj
Tento článok je čiastočný alebo úplný preklad článku EDTA na českej Wikipédii.


