Přesun elektronu ve vnější sféře
Přesun elektronu ve vnější sféře je druh přesunu elektronu probíhající mezi atomy, molekulami nebo ionty, které zůstávají před přesunem, během něj i po něm nedotčené.[1] Od přesunu elektronu ve vnitřní sféře se liší tím, že zúčastněná redoxní místa jsou propojena chemickým můstkem. Protože zde přesun probíhá mezi dvěma nepropojenými částicemi, elektron je nucen se pohybovat prostorem mezi jedním a druhým redoxním centrem.
Marcusova teorie
Hlavní teorii popisující rychlost přesunu elektronu ve vnější sféře vyvinul Rudolph A. Marcus v 50. letech 20. století. Hlavní součástí Marcusovy teorie je závislost rychlosti přesunu na termodynamické řídicí síle, kterou vytváří rozdíl redoxních potenciálů míst, mezi kterými dochází k výměně elektronů, u většiny reakcí se s rostoucí velikostí této síly rychlost reakce zvyšuje. Rychlost přesunu je rovněž nepřímo úměrná „reorganizační energii“, která popisuje změny délek vazeb a velikostí vazebných úhlů potřebných k tomu, aby si oxidant a reduktant vyměnili elektrony. Energie přesunů lze určit měřením rychlostí samovýměnných reakcí.
Přesun elektronu ve vnější sféře je nejběžnějším druhem přesunu elektronu, obzvláště pak v biochemii, kde jsou redoxní centra od reagujících proteinů vzdálena až 11 ångströmů. V biochemii se vyskytují dva hlavní druhy přesunu elektronu ve vnější sféře: mezi dvěma biomolekulami a přesun elektronu na pevnou vzdálenost, kdy se elektrony přesouvají v rámci jedné molekuly.[2]
Příklady
Samovýměnné reakce
Přesun elektronu ve vnější sféře může mimo jiné probíhat mezi částicemi stejného druhu, které se liší pouze oxidačními čísly;[3] takový proces se nazývá samovýměnná reakce. Příkladem je degenerovaná reakce tetraedrických manganistanových iontů s mangananovými:
- [MnO4]− + [Mn*O4]2− → [MnO4]2− + Mn*O4]−
U oktaedrických komplexů kovů záleží rychlosti těchto reakcí na změnách v obsazení eg orbitalů, která mají největší vliv na délky vazeb mezi kovy a ligandy:
- U dvojice [Co(bipy)3]+/[Co(bipy)3]2+ je rychlost reakce řádově 109 M−1s−1. Elektronová konfigurace se zde mění z (t2g)6(eg)2 (odpovídá kobaltnému iontu) na (t2g)5(eg)2 (odpovídající kobaltnatému iontu).
- V případě dvojice [Co(bipy)3]2+/[Co(bipy)3]3+ je reakční rychlost 18 M−1s−1. Změna elektronové konfigurace je z (t2g)5(eg)2 (Co2+) na (t2g)6(eg)0 (Co3+).
Fe-S proteiny
Přenosy elektronů ve vnější sféře tvoří základ biologických funkcí FeS proteinů. Fe centra jsou obvykle koordinována na další přes cysteinylové ligandy. [Fe4S4] transferní proteiny ([Fe4S4] ferredoxiny) lze dále rozdělit na nízkopotenciálové (bakteriálního type) a vysokopotenciálové (HiPIP) ferredoxiny. Vztah mezi nízko- a vysokopotenciálovými ferredoxiny odpovídá následujícímu redoxnímu schématu:
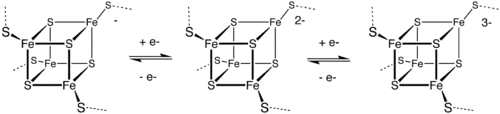
Jelikož jsou mezi jednotlivými redoxními stavy drobné strukturní rozdíly, tak přesun elektronu probíhá rychle.
Odkazy
Související články
- Přesun elektronu ve vnitřní sféře
Reference
V tomto článku byl použit překlad textu z článku Outer sphere electron transfer na anglické Wikipedii.
- Article: outer-sphere electron transfer, from the IUPAC Gold book]
- S. J. Lippard, J. M. Berg “Principles of Bioinorganic Chemistry” University Science Books: Mill Valley, CA; 1994 ISBN 0-935702-73-3
- R. G. Wilkins Kinetics and Mechanism of Reactions of Transition Metal Complexes, 2nd Edition, VCH, Weinheim, 1991. ISBN 1-56081-125-0