Methyldiethanolamin
Methyldiethanolamin (zkráceně MDEA) je organická sloučenina se vzorcem CH3N(C2H4OH)2. Jedná se o bezbarvou kapalinu se zápachem podobným amoniaku, mísitelnou s vodou, ethanolem a benzenem. Používá se při rafinaci ropy a výrobě syntézního a zemního plynu.[2]
| Methyldiethanolamin | |
|---|---|
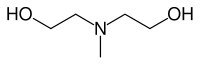
Strukturní vzorec | |
| Obecné | |
| Systematický název | 2,2'-(methylazandiyl)di(ethan-1-ol) |
| Ostatní názvy | bis(2-hydroxyethyl)(methyl)amin |
| Sumární vzorec | C5H13NO2 |
| Vzhled | bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 105-59-9 |
| EC-no (EINECS/ELINCS/NLP) | 203-312-7 |
| PubChem | 7767 |
| SMILES | CN(CCO)CCO |
| InChI | 1/C5H13NO2/c1-6(2-4-7)3-5-8/h7-8H,2-5H2,1H3 |
| Číslo RTECS | KL7525000 |
| Vlastnosti | |
| Molární hmotnost | 119,164 g/mol |
| Teplota tání | −21,00 °C (252,15 K) |
| Teplota varu | 247,1 °C (520,2 K) |
| Hustota | 1,038 g/cm3 |
| Viskozita | 101 mPa.s (20 °C) |
| Index lomu | 1,4694 |
| Rozpustnost ve vodě | mísitelný |
| Rozpustnost v polárních rozpouštědlech |
mísitelný s ethanolem |
| Rozpustnost v nepolárních rozpouštědlech |
rozpustný v benzenu |
| Tlak páry | 1 Pa (20 °C) |
| Bezpečnost | |
| [1] Varování[1] | |
| H-věty | H319 |
| P-věty | P305+351+338 |
| Teplota vzplanutí | 127 °C (400 K) |
| Teplota vznícení | 410 °C (683 K) |
| Meze výbušnosti | 1,4 až 8,8 % |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
K podobným sloučeninám patří monoethanolamin (MEA) a diethanolamin (DEA), které se, stejně jako MDEA, používají k čištění směsí plynů, zejména k odstraňování H2S a CO2.[2]
Methyldiethanolamin má při těchto činnostech oproti ostatním aminoalkoholům několik výhod, jako jsou odolnost vůči tepelnému a chemickému rozkladu, nemísitelnost s většinou uhlovodíků a malé reakční teplo při reakcích s oxidem uhličitým a sulfanem.
Vlastnosti
MDEA oproti jiným aminoalkoholům pomaleji reaguje s CO2, ovšem i tak je schopen pohltit téměř 1 mol CO2 na mol aminu.[3] K jeho regeneraci také stačí méně energie.[3] Za účelem spojení výhod MDEA a nižších aminů se často míchá s látkami jako jsou piperazin nebo reaktivní aminy (například monoethanolamin), čímž se zachovává reaktivita, ovšem dochází ke snížení nákladů na regeneraci. Piperazin funguje jako katalyzátor urychlující reakci s CO2.[4] Bylo provedeno několik srovnání reaktivity směsí MDEA+MEA a MDEA+piperazin s reaktivitou samotných aminů. Při stejném přívodu tepla a celkové molární koncentraci byla reakce s CO2 rychlejší u MEA; byl také zjištěn vznik významných množství vedlejších produktů.[3]
Rozklad
Produkty rozkladu methyldiethanolaminu jsou monoethanolamin (MEA), methylaminoethanol (MAE), diethanolamin (DEA), aminokyseliny bicin, glycin a hydroxyethylsarkosin, formylamidy MAE a DEA, amoniak a stabilní soli mravenčany, glykoláty, octany a šťavelany.[5] Zvyšování reakční teploty a rychlosti přidávání CO2 vede k urychlení rozkladu, snížení zásaditosti a tvorby mravenčanů. MDEA je vůči tomuto rozkladu odolnější než MEA, a tak se více rozkládá ve směsi MDEA+MEA.[5] Jelikož dochází ke vzniku DEA a MAE, které mohou tvořit nitrososloučeniny, diethylnitrosaminy a nebo diethylnitrain, tak může mít použití směsi nepříznivý vliv na atmosféru.[5]
Výroba
Methyldiethanolamin se vyrábí ethoxylací methylaminu pomocí ethylenoxidu:[2]
- CH3NH2 + 2 C2H4O → CH3N(C2H4OH)2
Lze také použít hydroxymethylaci diethanolaminu a následnou hydrogenolýzu.
Reference
V tomto článku byl použit překlad textu z článku Methyl diethanolamine na anglické Wikipedii.
- N-Methyldiethanolamine. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- Matthias Frauenkron, Johann-Peter Melder, Günther Ruider, Roland Rossbacher, Hartmut Höke "Ethanolamines and Propanolamines" in Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim.DOI:10.1002/14356007.a10_001
- Raphael Idem. Pilot Plant Studies of the CO2 Capture Performance of Aqueoues MEA and Mixed MEA/MDEA Solvents at the University of Regina CO2 Capture Technology Development Plant and the Boundary Dam CO2 Capture Demonstration Plant. Industrial & Engineering Chemistry Research. 2006, s. 2414–2420.
- Piperazine – Why It's Used and How It Works. The Contactor. 2008. Dostupné online.
- M. E. Boot-Handford. Carbon Capture and Storage Update Amines. Energy & Environment. 2014, s. 130–189.
