ITAM
ITAM (z anglického immunoreceptor tyrosine-based activation motif) je konzervovaná sekvence čtyř aminokyselin, která se dvakrát opakuje v intracelulárních částech nekatalytických receptorů, jejichž funkce je závislá na fosforylaci tyrosinu. Tyto receptory se nejčastěji nachází na buňkách imunitního systému.[1] Jejich hlavní role je jejich integrální účast na spuštění celé řady signálních drah a následné aktivaci imunitní buňky. Hrají ovšem také klíčovou roli při signalizaci v jiných buněčných typech, jako například při zrání osteoklastů.[2][3]
Struktura
Tento motiv obsahuje tyrosin, který je oddělen od leucinu nebo isoleucinu jakýmikoliv dvěma aminokyselinami (YxxL/I).[1] Dvě tyto sekvence jsou od sebe odděleny 6 až 8 aminokyselinami (YxxL/Ix(6-8)YxxL/I) a nachází se v intracelulární části receptorů. Nicméně je třeba zmínit, že z hlediska konsenzuální ITAM sekvence není literatura zcela konzistentní, a to především v počtu dělících aminokyselin. Kromě ITAM motivů, které mají takovou strukturu, jaká byla popsána výše, existují také motivy s velice podobnou strukturou a funkcí, jako je ITAM motiv (například v proteinu Dectin-1).[4][5][6]
Funkce
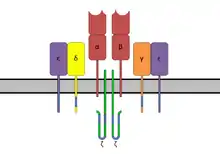
ITAM sekvence jsou důležité pro přenos signálu, především v imunitních buňkách. Nachází se v intracelulárích částech nekatalytických receptorů, jejichž funkce je závislá na fosforylaci tyrosinu[7], jako je CD3 a ζ-řetězec komplexu T-buněčného receptoru, CD79-α a -β komplexu B-buněčného receptoru, některé Fc receptory, a další.[1][7] Po interakci přidruženého receptoru se svým ligandem a následné aktivaci kinázy z proteinové rodiny Src je tyrosin v těchto sekvencích fosforylován. Fosforylované ITAM sekvence slouží jako vazebné místo pro proteiny obsahující SH2 doménu (obvykle dvě domény, které jsou od sebe odděleny krátkou vazebnou sekvencí aminokyselin), které poté spouští signální kaskády založené na kinázách z proteinové rodiny Syk, a to buď Syk nebo ZAP-70, což nejčastěji vede k aktivaci dané buňky. V některých případech ovšem paradoxně nedochází k aktivačnímu efektu, ale k efektu inhibičnímu.[8][9][10] Přesný mechanismus tohoto fenoménu v tuto chvíli zatím ještě není zcela objasněn.
Jiné nekatalytické receptory, jejichž funkce je závislá na fosforylaci tyrosinu, obsahují sekvenci s konzervovaným inhibičním motivem (ITIM), které po fosforylaci slouží jako vazebné místo pro fosfatázy SHP-1, SHP-2 a SHIP1. Tyto fosfatázy pak slouží nejen k inhibici a regulaci signálních drah založených na Syk nebo ZAP-70, ale také k ukončení této signalizace po úspěšné aktivaci.[11][12][13]
Genetické variace
Vzácné lidské genetické mutace, které jsou katalogizované v databázích lidské genetické variace[14][15][16], mohou údajně vést k vzniku i zániku jak ITAM sekvencí, tak ITIM sekvencí.[17]
Příklady
Níže uvedené příklady obsahují jak proteiny, které obsahují ITAM sekvence, tak i proteiny, které ITAM k signalizaci využívají za pomoci přidružených proteinů, které danou sekvenci obsahují.
CD3γ, CD3δ, CD3ε, DAP12, FcαRI, FcγRI, FcγRII, FcγRIII, Dectin-1, CLEC-1, CD28, CD72
Reference
V tomto článku byl použit překlad textu z článku Immunoreceptor tyrosine-based activation motif na anglické Wikipedii.
- ABBAS, ABUL K. Basic immunology : functions and disorders of the immune system. 3rd ed. vyd. Philadelphia, PA: Saunders/Elsevier viii, 312 pages s. Dostupné online. ISBN 978-1-4160-4688-2, ISBN 1-4160-4688-7. OCLC 156994568
- HUMPHREY, Mary Beth; DAWS, Michael R; SPUSTA, Steve C. TREM2, a DAP12-Associated Receptor, Regulates Osteoclast Differentiation and Function. Journal of Bone and Mineral Research. 2005-10-20, roč. 21, čís. 2, s. 237–245. Dostupné online [cit. 2020-09-06]. DOI 10.1359/JBMR.051016. (anglicky)
- PALONEVA, Juha; MANDELIN, Jami; KIIALAINEN, Anna. DAP12/TREM2 Deficiency Results in Impaired Osteoclast Differentiation and Osteoporotic Features. Journal of Experimental Medicine. 2003-08-18, roč. 198, čís. 4, s. 669–675. Dostupné online [cit. 2020-09-06]. ISSN 1540-9538. DOI 10.1084/jem.20030027. PMID 12925681. (anglicky)
- ROGERS, Neil C.; SLACK, Emma C.; EDWARDS, Alexander D. Syk-Dependent Cytokine Induction by Dectin-1 Reveals a Novel Pattern Recognition Pathway for C Type Lectins. Immunity. 2005-04, roč. 22, čís. 4, s. 507–517. Dostupné online [cit. 2020-09-06]. DOI 10.1016/j.immuni.2005.03.004. (anglicky)
- UNDERHILL, David M.; ROSSNAGLE, Eddie; LOWELL, Clifford A. Dectin-1 activates Syk tyrosine kinase in a dynamic subset of macrophages for reactive oxygen production. Blood. 2005-10-01, roč. 106, čís. 7, s. 2543–2550. Dostupné online [cit. 2020-09-06]. ISSN 0006-4971. DOI 10.1182/blood-2005-03-1239. PMID 15956283. (anglicky)
- SUZUKI-INOUE, K. A novel Syk-dependent mechanism of platelet activation by the C-type lectin receptor CLEC-2. Blood. 2006-01-15, roč. 107, čís. 2, s. 542–549. Dostupné online [cit. 2020-09-06]. ISSN 0006-4971. DOI 10.1182/blood-2005-05-1994. (anglicky)
- DUSHEK, Omer; GOYETTE, Jesse; VAN DER MERWE, P. Anton. Non-catalytic tyrosine-phosphorylated receptors. Immunological Reviews. 2012-11, roč. 250, čís. 1, s. 258–276. Dostupné online [cit. 2020-09-06]. DOI 10.1111/imr.12008. (anglicky)
- PASQUIER, Benoit; LAUNAY, Pierre; KANAMARU, Yutaka. Identification of FcαRI as an Inhibitory Receptor that Controls Inflammation. Immunity. 2005-01, roč. 22, čís. 1, s. 31–42. Dostupné online [cit. 2020-09-06]. DOI 10.1016/j.immuni.2004.11.017. (anglicky)
- O'NEILL, Shannon K.; GETAHUN, Andrew; GAULD, Stephen B. Monophosphorylation of CD79a and CD79b ITAM Motifs Initiates a SHIP-1 Phosphatase-Mediated Inhibitory Signaling Cascade Required for B Cell Anergy. Immunity. 2011-11, roč. 35, čís. 5, s. 746–756. Dostupné online [cit. 2020-09-06]. DOI 10.1016/j.immuni.2011.10.011. PMID 22078222. (anglicky)
- PFIRSCH-MAISONNAS, S.; ALOULOU, M.; XU, T. Inhibitory ITAM Signaling Traps Activating Receptors with the Phosphatase SHP-1 to Form Polarized "Inhibisome" Clusters. Science Signaling. 2011-04-19, roč. 4, čís. 169, s. ra24–ra24. Dostupné online [cit. 2020-09-06]. ISSN 1945-0877. DOI 10.1126/scisignal.2001309. (anglicky)
- LONG, Eric O. Negative signaling by inhibitory receptors: the NK cell paradigm. Immunological Reviews. 2008-08, roč. 224, čís. 1, s. 70–84. Dostupné online [cit. 2020-09-06]. DOI 10.1111/j.1600-065X.2008.00660.x. PMID 18759921. (anglicky)
- KANE, Barry A.; BRYANT, Katherine J.; MCNEIL, H. Patrick. Termination of Immune Activation: An Essential Component of Healthy Host Immune Responses. Journal of Innate Immunity. 2014, roč. 6, čís. 6, s. 727–738. Dostupné online [cit. 2020-09-06]. ISSN 1662-8128. DOI 10.1159/000363449. PMID 25033984. (anglicky)
- LIGETI, E.; CSÉPÁNYI-KÖMI, R.; HUNYADY, L. Physiological mechanisms of signal termination in biological systems. Acta Physiologica. 2012-04, roč. 204, čís. 4, s. 469–478. Dostupné online [cit. 2020-09-06]. DOI 10.1111/j.1748-1716.2012.02414.x. (anglicky)
- THE 1000 GENOMES PROJECT CONSORTIUM. A global reference for human genetic variation. Nature. 2015-10, roč. 526, čís. 7571, s. 68–74. Dostupné online [cit. 2020-09-06]. ISSN 0028-0836. DOI 10.1038/nature15393. PMID 26432245. (anglicky)
- SHERRY, S. T. dbSNP: the NCBI database of genetic variation. Nucleic Acids Research. 2001-01-01, roč. 29, čís. 1, s. 308–311. Dostupné online [cit. 2020-09-06]. DOI 10.1093/nar/29.1.308. PMID 11125122.
- GENOME AGGREGATION DATABASE PRODUCTION TEAM; GENOME AGGREGATION DATABASE CONSORTIUM; CUMMINGS, Beryl B. Transcript expression-aware annotation improves rare variant interpretation. Nature. 2020-05, roč. 581, čís. 7809, s. 452–458. Dostupné online [cit. 2020-09-06]. ISSN 0028-0836. DOI 10.1038/s41586-020-2329-2. PMID 32461655. (anglicky)
- ULAGANATHAN, Vijay Kumar. TraPS-VarI: Identifying genetic variants altering phosphotyrosine based signalling motifs. Scientific Reports. 2020-12, roč. 10, čís. 1, s. 8453. Dostupné online [cit. 2020-09-06]. ISSN 2045-2322. DOI 10.1038/s41598-020-65146-2. PMID 32439998. (anglicky)