Hexametafosforečnan sodný
Hexametafosforečnan sodný je hexamerní anorganická sloučenina se vzorcem (NaPO3)6. Volně prodávaný hexametafosforečnan sodný je obvykle směsí různých polymetafosforečnanů, a přesněji by se tak měl nazývat polymetafosforečnan sodný.
| Hexametafosforečnan sodný | |
|---|---|
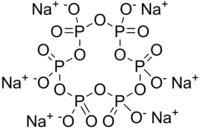
Strukturní vzorec | |
| Obecné | |
| Systematický název | cyklo-hexafosforečnan sodný |
| Ostatní názvy | hexametafosforečnan sodný |
| Funkční vzorec | (NaPO3)6 |
| Sumární vzorec | Na6P6O18 |
| Vzhled | bílé krystaly |
| Identifikace | |
| Registrační číslo CAS | 10124-56-8 |
| EC-no (EINECS/ELINCS/NLP) | 233-343-1 |
| PubChem | 24968 |
| SMILES | [O-]P1(=O)OP(=O)([O-])OP(=O)([O-])OP(=O)(OP(=O)(OP(=O)(O1)[O-])[O-])[O-].O=C(OC(C)(C)C)NC(=O)OC(C)(C)C.[Na+].[Na+].[Na+].[Na+].[Na+].[Na+] |
| InChI | 1S/6Na.H6O18P6/c;;;;;;1-19(2)13-20(3,4)15-22(7,8)17-24(11,12)18-23(9,10)16-21(5,6)14-19/h;;;;;;(H,1,2)(H,3,4)(H,5,6)(H,7,8)(H,9,10)(H,11,12)/q6*+1;/p-6 |
| Vlastnosti | |
| Molární hmotnost | 611,77 g/mol |
| Teplota tání | 628 °C (901 K) |
| Teplota varu | 1500 °C (1773 K) |
| Hustota | 2,484 g/cm3 |
| Index lomu | 1,482 |
| Rozpustnost ve vodě | rozpustný |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Výroba
Hexametafosforečnan sodný se vyrábí zahříváním fosforečnanu sodného za vzniku difosforečnanu,
- 2 NaH2PO4 → Na2H2P2O7 + H2O
který je dále zahříván za tvorby hexametafosforečnanu.
- 3 Na2H2P2O7 → (NaPO3)6 + 3 H2O
Výsledný produkt je poté prudce ochlazen.
Reakce
Hexametafosforečnan sodný ve vodných roztocích, obzvláště okyselených, hydrolyzuje na trimetafosforečnan sodný a fosforečnan sodný.[1]
Použití
Hexametafosforečnan sodný funguje jako sekvestrant a používá se takto v mnoha oblastech, například v potravinářství, kde se označuje jako E 452i. Někdy se do něj za účelem zvýšení pH přidává uhličitan sodný, takovéto směsi se používají na odstraňování tvrdosti vody a jako detergenty.
Hexametafosforečnan sodný má využití jako vločkovací činidlo při výrobě keramiky.[2][3][4][5] Také se používá v zubních pastách, kde napomáhá předcházení zubnímu kameni.[6]
Historie
Kyselinu hexametafosforečnanovou pojmenoval (ovšem nesprávně identifikoval) v roce 1849 německý chemik Theodor Fleitmann.[10][11] V roce 1956 byly pomocí chromatografie na tenké vrstvě zanalyzovány produkty hydrolýzy Grahamovy soli (polyfosforečnanu sodného), výsledky ukazovaly na přítomnost více než čtyřčlenných cyklických polyfosforečnanů;[12] tento objev byl potvrzen v roce 1961.[13] Roku 1963 připravili Erich Thilo a Ulrich Schülke hexametafosforečnan sodný zahříváním bezvodého trimetafosforečnanu sodného.[14]
Reference
V tomto článku byl použit překlad textu z článku Sodium hexametaphosphate na anglické Wikipedii.
- John Van Wazer. Phosphorus and its Compounds. New York: Interscience Publishers Dostupné online.
- The Role Of Sodium Hexametaphosphate In The Dissolution Process Of Kaolinite And KaolinF. Andreola; E.Castellini; T.Manfredini; M.Romagnoli. Journal of the European Ceramic Society, Volume 24, Number 7, June 2004.
- Impact Of Dispersants On The Mechanical Strength Development Of Alumina-Spinel Self-Flowing Refractory Castables. Sasan Otroj, Mohammad Reza Nilforushan, Arash Daghighi, Reza Marzban. Ceramics – Silikáty 54 (3) 284–289 (2010)
- Effect Of Adding Sodium Hexametaphosphate Liquefier On Basic Properties Of Calcium Phosphate Cements. S. Hesaraki; A. Zamanian; F. Moztarzadeh. Journal of Biomedical Materials Research Part A. Vol. 88A, No. 2, 2009
- Study Of Clay’s Mineralogy Effect On Rheological Behavior Of Ceramic Suspensions Using An Experimental Design. Afef Jmal Ayadi; Julien Soro; Amel Kamoun; Samir Baklouti. International Journal of Recent Research and Applied Studies 14 (2). February 2013.
- Crest Pro-Health Frequently Asked Questions
- Ingredient Results - Sodium Hexametaphosphate [online]. Dostupné online.
- Food Additives & Ingredients - Food Additive Status List [online]. Dostupné online.
- CFR - Code of Federal Regulations Title 21 [online]. Dostupné online.
- Theodor Fleitmann. Ueber die verschiedenen Metaphosphorsäuren und zwei neue Säuren derselben Verbindungsproportion. Annalen der Physik und Chemie. 1849, s. 233–260, 338–366. Dostupné online.
- E. J. Griffith; R. L. Buxton. The preparation and properties of the twelve-membered ring hexametaphosphate anion. Inorganic Chemistry. 1965, s. 549–551. DOI 10.1021/ic50026a023.
- J. R. Van Wazer; E. Karl Kroupa. Existence of ring phosphates higher than tetrametaphosphate. Journal of the American Chemical Society. 1956, s. 1772. DOI 10.1021/ja01589a086.
- (Thilo & Schülke, 1963a), p. 1175.
- Erich Thilo; Ulrich Schülke. Darstellung des echten Natrium-hexametaphosphates Na6[P6O18]. Angewandte Chemie. 1963, s. 1175–1176. DOI 10.1002/ange.19630752305.