Frémyova sůl
Frémyova sůl (systematický název nitrosodisulfonát draselný) je anorganická sloučenina se vzorcem (K4[ON(SO3)2]2), někdy psaným i jako (K2[NO(SO3)2]). V pevném skupenství má žlutohnědou barvu, její vodné roztoky jsou světle fialové.[2][3] Obdobná sodná sůl, nitrosodisulfonát sodný (NDS, Na2ON(SO3)2, CAS 29554-37-8) bývá rovněž nazývána Frémyova sůl.[4]
| Frémyova sůl | |
|---|---|
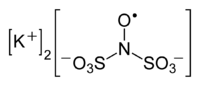
Strukturní vzorec | |
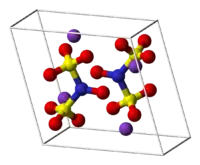
Model jednotkové buňky | |
| Obecné | |
| Systematický název | nitrosodisulfonát draselný |
| Funkční vzorec | [K+]2[NO•(SO3)2]- |
| Sumární vzorec | K2NO7S |
| Vzhled | žlutohnědá pevná látka |
| Identifikace | |
| Registrační číslo CAS | 106-93-4 |
| PubChem | 3032624 |
| SMILES | N([O])(S(=O)(=O)[O-])S(=O)(=O)[O-].[K+].[K+] |
| InChI | 1S/2K.H2NO7S2/c;;2-1(9(3,4)5)10(6,7)8/h;;(H,3,4,5)(H,6,7,8)/q2*+1;/p-2 |
| Vlastnosti | |
| Molární hmotnost | 268,33 g/mol |
| Bezpečnost | |
| [1] | |
| H-věty | H260 H302 H312 H332[1] |
| P-věty | P223 P231+232 P261 P264 P270 P271 P280 P302+335+334 P302+352 P304+340 P321 P330 P370+378 P402+404 P501[1] |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Vodné roztoky těchto solí obsahují radikál [ON(SO3)2]2−.
Použití
Frémyova sůl jakožto stabilní radikál slouží v elektronové paramagnetické rezonanci (EPR) jako standard pro kvantifikaci radikálů. V jeho EPR spektru jsou tři výrazné čáry stejné s odstupy o velikosti přibližně 1,3 mT.[5][6][7]
Aminoxylová skupina patří mezi stálé radikály, podobně jako TEMPO.
Frémyova sůl se zapojuje do některých oxidačních reakcí, jako jsou oxidace některých anilinů a fenolů,[8][9][10][11] kde zprostředkovává polymerizace a překřižování peptidů a peptidových hydrogelů.[12][13]
Také může sloužit jako model peroxylových radikálů při výzkumu mechanismu antioxidačních účinků řady přírodních látek.[14]
Příprava
Frémyova sůl se připravuje z kyseliny hydroxylamindisulfonové. Oxidací její konjugované zásady vzniká fialový dianion:
- HON(SO3H)2 → [HON(SO3)2]2− + 2 H+
- 2 [HON(SO3)2]2− + PbO2 → 2 [ON(SO3)2]2− + PbO + H2O
Uvedenou kyselinu je možné získat z dusitanu a hydrogensiřičitanu, čímž vzniká hydroxylamindisulfonát. Oxidace se obvykle provádí za nízké teploty, buď chemicky nebo elektrolyticky.[4][3]
K dalším reakcím patří:
- HNO2 + 2 HSO -
3 → HON(SO3) 2-
2 + H2O - 3 HON(SO3) 2-
2 + MnO -
4 + H+ → 3 ON(SO3) 2-
2 + MnO2 + 2 H2O - 2 ON(SO3) 2-
2 + 4 K+ → K4[ON(SO3)2]2
Historie
Nitrosodisulfonát draselný poprvé připravil Edmond Frémy v roce 1845.[15] Její používání v organické syntéze zavedl Hans Teuber, oxidace pomocí této soli se označují jako Teuberovy reakce.[16][10]
Odkazy
Literatura
- J. Morey. Undergraduate Experiments with a Long-Lived Radical (Frémy's salt): Synthesis of 1,4-Benzoquinones by Degradative Oxidation of p-Hydroxybenzyl Alcohols. Journal of Chemical Education. 1988, s. 627–629. DOI 10.1021/ed065p627. Bibcode 1988JChEd..65..627M.
Reference
V tomto článku byl použit překlad textu z článku Frémy's salt na anglické Wikipedii.
- https://pubchem.ncbi.nlm.nih.gov/compound/3032624
- Šablona:Greenwood&Earnshaw2nd
- Synthesis and Characterization of Potassium Nitrosodisulfonate, Frémy's Salt [online]. Dostupné online.
- P. A. Wehrli; F. Pigott. Oxidation with the nitrosodisulfonate radical. I. Preparation and use of sodium nitrosodisulfonate: trimethyl-p-benzoquinone. Organic Syntheses. 1972, s. 83. DOI 10.15227/orgsyn.052.0083.
- J. E. Wertz; J. R. Bolton. Electron Spin Resonance: Elementary Theory and Practical Applications. New York: McGraw-Hill, 1972. ISBN 978-0-07-069454-5. S. 697–717.
- S. Colacicchi; V. Carnicelli; G. Gualtieri; A. Di Giulio. EPR study of Frémy's salt nitroxide reduction by ascorbic acid; influence of bulk pH values. Research on Chemical Intermediates. 2000, s. 885–896. DOI 10.1163/156856700X00372.
- J. Zielonka; H. Zhao; Y. Xu; B. Kalyanaraman. Mechanistic similarities between oxidation of hydroethidine by Frémy's salt and superoxide: stopped-flow optical and EPR studies. Free Radical Biology & Medicine. 2005, s. 853–863. DOI 10.1016/j.freeradbiomed.2005.05.001. PMID 16140206.
- H. Zimmer; D. C. Lankin; S. W. Horgan. Oxidations with potassium nitrosodisulfonate (Frémy's radical). Teuber reaction. Chemical Reviews. 1971, s. 229–246. DOI 10.1021/cr60270a005.
- I. Islam; E. B. Skibo; R. T. Dorr; D. S. Alberts. Structure-activity studies of antitumor agents based on pyrrolo[1,2-a]benzimidazoles: new reductive alkylating DNA cleaving agents. Journal of Medicinal Chemistry. 1991, s. 2954–2961. DOI 10.1021/jm00114a00. PMID 1920349.
- H. J. Teuber. Use of dipotassium nitrosodisulfonate (Frémy's salt): 4,5-dimethyl-o-benzoquinone. Organic Syntheses. 1972, s. 88. DOI 10.15227/orgsyn.052.0088.
- W. Xue; D. Warshawsky; M. Rance; K. Jayasimhulu. A metabolic activation mechanism of 7H-dibenzo[c,g]carbozole via o-quinone. Part 1: synthesis of 7H-dibenzo[c,g]carbozole-3,4-dione and reactions with nucleophiles. Polycyclic Aromatic Compounds. 2002, s. 295–300. DOI 10.1080/10406630290026957.
- M. Wilchek; T. Miron. Mussel-inspired new approach for polymerization and cross-linking of peptides and proteins containing tyrosines by Frémy's salt oxidation. Bioconjugate Chemistry. 2015, s. 502–510. DOI 10.1021/bc5006152. PMID 25692389.
- G. Fichman; J. P. Schneider. Utilizing Frémy's Salt to Increase the Mechanical Rigidity of Supramolecular Peptide-Based Gel Networks. Frontiers in Bioengineering and Biotechnology. 2021. DOI 10.3389/fbioe.2020.594258. PMID 33469530.
- Z. L. Liu; Z. X. Han; P. Chen; Y. C. Liu. Stopped-flow ESR study on the reactivity of vitamin E, vitamin C and its lipophilic derivatives towards Frémy's salt in micellar systems. Chemistry and Physics of Lipids. 1990. DOI 10.1016/0009-3084(90)90090-E. PMID 1965427.
- Viz:
- Frémy, E. (1845) "Sur un nouvelle série d'acides formés d'oxygène, de soufre, d'hydrogène et de d'azote", Annales de Chimie et de Physique, 3rd series, 15 : 408-488.
- Frémy, E. (1845) "Sur un nouvelle série d'acides formés d'oxygène, de soufre, d'hydrogène et de d'azote", Comptes rendus, 21 : 218–226.
- "Séances académiques," L'Institut, no. 604, 23 July 1845, pp. 265–266.
- "Séances académiques," L'Institut, no. 619, 12 November 1845, pp. 393.
- Edward Divers and Tamemasa Haga (1900) "Identification and constitution of Frémy's sulphazotised salts of potassium," Journal of the Chemical Society, Transactions, 77 : 440-446. doi:10.1039/CT9007700440 Na p. 445 je sůl, kterou Frémy nazval sulfazidátem identifikována jako ON(SO3K)2.
- H. J. Teuber; S. Benz. Reaktionen mit Nitrosodisulfonat, XXXVI. Chinolin-chinone-(5.6) aus 5-Hydroxy-chinolinen. Chemische Berichte. 1967, s. 2918–2929. Dostupné online. DOI 10.1002/cber.19671000916.

