Ethen
Ethen (starší názvy: ethylen, etylén) je nejjednodušším zástupcem uhlovodíků ze skupiny alkenů. Je to bezbarvý hořlavý plyn nasládlé vůně s teplotou tání −169,1 °C. Se vzduchem tvoří výbušnou směs. Bývá obsažen v zemním a koksárenském plynu, dále se získává krakováním. Patří mezi základní suroviny v chemickém průmyslu. Používá se k výrobě ethylenoxidu, polyethylenu, styrenu aj. Odštěpením jednoho atomu vodíku vzniká funkční skupina ethenyl (triviálním názvem vinyl), která se může dále vázat na jiné sloučeniny.
| Ethen | |
|---|---|
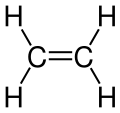
Strukturní vzorec | |

3D model | |
| Obecné | |
| Systematický název | Ethen |
| Triviální název | Ethylen |
| Sumární vzorec | C2H4 |
| Identifikace | |
| Registrační číslo CAS | 74-85-1 |
| EC-no (EINECS/ELINCS/NLP) | 200-815-3 |
| Indexové číslo | 601-010-00-3 |
| Vlastnosti | |
| Molární hmotnost | 28,05 g/mol |
| Teplota tání | −169,1 °C |
| Teplota varu | −103,7 °C |
| Hustota | 0,001 178 g/cm³ (plyn, 15 °C) |
| Rozpustnost ve vodě | 25 ml/100 ml (0 °C) 12 ml/100 ml (25 °C) |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H220 H336 |
| R-věty | R12 R67 |
| S-věty | (S2) S9 S16 S33 S46 |
| NFPA 704 |  4
1
2
|
| Teplota vznícení | 490 °C |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Chemické vlastnosti
Oxidační reakce
V nadbytku kyslíku hoří ethen na oxid uhličitý a vodu.
- CH2=CH2 + 3 O2 → 2 CO2 + 2 H2O
V přítomnosti stříbra jako katalyzátoru, dochází za zvýšeného tlaku a při teplotě 220–280 °C ke vzniku ethylenoxidu. Ten reaguje dále s vodou za vzniku ethylenglykolu.
- 2 CH2=CH2 + O2 → 2 C2H4O
- C2H4O + H2O → HOCH2CH2OH
Polymerace
Ethen polymeruje za vysokého tlaku nebo v přítomnosti Zieglerova–Nattova katalyzátoru za vzniku polyethylenu.
- n CH2=CH2 → [-CH2-CH2-]n
Ethen jako fytohormon
V přírodě se přirozeně vyskytuje jako metabolit rostlin mající charakter fytohormonu. Jeho tvorba v rostlinách je ovlivňována auxiny.[2]. Vysoká lokální hladina auxinu vede k lokální biosyntéze etylenu. Etylen pak naopak, mimo jiné, ovlivňuje transport auxinu z buněk.
Biosyntéza ethenu
Jeho biosyntéza vychází z ATP a methioninu, z kterých vzniká činností ACC syntázy ACC kyselina (1-aminocyklopropan-1-karboxylová kyselina). Ta je ACC oxidázou a kyslíkem oxidována na kyanid, oxid uhličitý a ethen.
Fyziologické efekty ethenu
V klíčních rostlinách vyvolává tzv. trojí efekt – etiolizované klíční rostliny jsou kratší, silnější a mají porušenou orientaci v prostoru. Urychluje senescenci květů, zrání plodů a opadávání listů. Stimuluje tvorbu kořenových vlásků. Působí epinastii listů.[3]
Přenos signálu
Receptor pro ethen se nachází na membráně endoplazmatického retikula. Pro vazbu je potřeba měď. Pokud není ethen přítomen, receptory tvoří dimery, trans-autofosforylují se na histidinu, odkud se fosfát přenáší na aspartát, z něhož odchází na kinázu CTR1, která je tím aktivována a blokuje regulační protein EIN2 (srovnej s cytokininem).
Pokud je ethen přítomen, ztrácí receptorový dimer kinázovou aktivitu a neaktivuje CTR1, která tedy neblokuje EIN2. Funkční EIN2 aktivuje transkripční faktor EIN3, který dimerizuje s transkripčním faktorem ERF1 a společně regulují geny řízené ethenem.
Odkazy
Reference
- Ethylene. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- Mohr, Schopfer. Plant Physiology. [s.l.]: Springer-Verlag Berlin, 1995. Dostupné online. (anglicky)
- KŮDELA, Václav. Abiotikózy rostlin: poruchy, poškození a poranění.. 1.. vyd. Praha: Academia, 2013. (Živá příroda). ISBN 978-80-200-2262-2. S. 217–219.
Externí odkazy
 Obrázky, zvuky či videa k tématu Ethen na Wikimedia Commons
Obrázky, zvuky či videa k tématu Ethen na Wikimedia Commons  Encyklopedické heslo Aethylen v Ottově slovníku naučném ve Wikizdrojích
Encyklopedické heslo Aethylen v Ottově slovníku naučném ve Wikizdrojích- Ovoce v plastovém sáčku prý dozraje rychleji. Je to pravda? A co je příčinou? Dotaz z webu prirodovedci.cz

