Cytotoxický T-lymfocyt
Cytotoxické T lymfocyty (dále také TC, CD8+ T buňky, CD4- T buňky) jsou typem bílých krvinek podílejích se na imunitní odpovědi organismu. Zaměřují se na ochranu organismu před intracelulárními patogeny, včetně virů, bakterií a parasitů, které se rozmnožují uvnitř hostitelské buňky. V ideálním případě donutí cytotoxické lymfocyty napadené hostitelské buňky k buněčné smrti dříve, než se z nich patogeny mohou dostat do prostředí.[1]
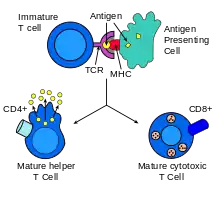
Na membránách cytotoxických T lymfocytů se nachází proteiny (TCR), které se mohou vázat na specifický antigen. Antigeny jsou prezentovány na membránách všech tělu vlastních buněk proteiny MHC typu I. Pokud se při kontaktu cytotoxického T lymfocytu a kontrolované buňky TCR receptory naváží na presentované antigeny, je to pro lymfocyt signál k likvidaci dané buňky.
Samotná afinita TCR ke specifickému proteinu je však relativně malá a pro funkci lymfocytu nedostačující – proto je třeba podpůrný protein zvaný CD8. Ten se naváže na konstantní část MHC typu I. Afinita mezi CD8 a MHC „přidrží“ lymfocyt a cílovou buňku pevněji u sebe během antigen-specifické aktivace. Odtud tedy název CD8+ T buňky.
Vývoj
Imunitní systém musí rozpoznat miliony potenciálních antigenů. V lidském genomu je však méně než 30 000 genů, tudíž mít pro každý antigen odpovídající gen není možné. Z toho důvodu je genetická informace v buňkách lymfocytů rekombinována, aby mohly být vytvořeny nové buňky s unikátními receptory schopnými vázat co největší množství antigenů. Rekombinací nicméně může dojít i k vytvoření buněk s afinitou k tělu vlastním antigenům. Aby nedocházelo ke vzniku autoimunitních onemocnění, prochází lymfocyty selekcí.
Lymfocyty se vyvíjejí z hematopoetických kmenových buněk, které migrují z kostní dřeň do brzlíku. Juvenilní lymfocyty, vyvíjející se v brzlíku, se nazývají tymocyty. Podle typu TCR proteinu jsou rozlišitelné 2 typy lymfocytů. TCR má vždy dva řetězce, obvykle alfa-beta a v malé menšině buněk (cca 5 %) gama-delta. Funkce dospělých lymfocytů se bude lišit podle typu TCR – lymfocyty s alfa-beta řetězcem se specializují na proteinové antigeny, lymfocyty s gama-delta řetězcem se nacházejí v epiteliálních buňkách (třeba ve střevě).
DN fáze vývoje
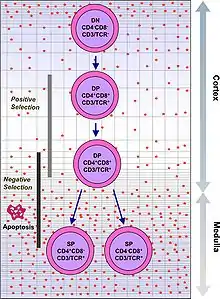
V prvních fázích vývoje tymocyty postrádají CD4 i CD8 proteiny a jsou to takzvaně „double negative“ (DN) buňky. Různá stádia vývoje tymocytů rozlišujeme podle přítomnosti CD44 a CD25 molekul. DN1 buňky jsou nejmladšími tymocyty. Typicky jsou CD44 pozitivní a CD25 negativní. DN2 buňky jsou již i CD44+ i CD25+.
Ve stadiu DN3, kdy je tymocyt CD44- a CD25+ dochází k rekombinaci beta řetězce. Tymocyty pak procházejí tzv. beta selekcí, při které jsou vybírány ty buňky, které úspěšně naváží vlákno substituující alfa řetězec (pre-Tα). Pokud tato interakce proběhne úspěšně, znamená to, že rekombinace beta řetězce proběhla v buňce tak, jak měla, a vznikne tzv. pre-TCR komplex. Buňky s tímto komplexem se dostávají do fáze DN4, jsou CD44- i CD25- a již nerekombinují beta řetězec, ale přežívají, proliferují a začínají exprimovat CD4 a CD8 proteiny.
DP fáze vývoje
Buňky exprimující CD4 i CD8 jsou takzvaně „double positive“ (DP). U DN3 buněk neschopných navázat pre-Tα nastává buněčná smrt.DP buňky rekombinují svůj alfa řetězec, a produkují hotový αβ-TCR protein. Tento vysoce variabilní proces genetické rekombinace umožňuje organismu vytvořit miliony T lymfocytů s rozdílnými TCR proteiny, které mohou odpovědět na téměř jakýkoli potenciální patogen. V brzlíku poté prochází v rámci svého dalšího vývoje pozitivní a negativní selekcí, aby bylo rozhodnuto, zda jsou jednak efektivní, jednak bezpečné pro tělu vlastní buňky.[2]
Selekce
Pozitivní selekcí, probíhající v cortexu brzlíku, prochází DP buňky jako první. Ty, které projeví příliš slabou afinitu k antigenům presentovaným antigen prezentujícími buňkami (APC) jsou vyhodnoceny jako neefektivní a dochází u nich k buněčné smrti.
Negativní selekcí prochází tymocyty poté, co doputují z kůry brzlíku do vnitřní vrstvy (medulla). Antigen presentující buňky, jako jsou makrofágové nebo dendritické buňky, prezentují DP buňkám tělu vlastní molekuly. Pokud na ně reagují příliš agresivně, dojde k jejich vyřazení a buněčné smrti. Ve chvíli kontaktu s APC dojde u DP buňky downregulací k diferenciaci na naivní CD4+ nebo CD8+ T lymfocyt. Tento proces nepřežije většina tymocytů a jen malé procento dospívá. V případě cytotoxického lymfocytu se diferencuje na CD8+ buňku.
Aktivace
Dospělé cytotoxické T lymfocyty cirkulují tělem, zejména lymfatickým oběhem a jsou neaktivní. Pro jejich aktivaci je třeba série několika navazujících signálů.
Antigen presentující buňky jsou schopny aktivace cytotoxických lymfocytů pomocí zkřížené prezentace (anglicky cross-presentation), což je proces, při kterém APC prezentují fragmenty antigenu na svém vlastním MHC I, přestože sami nejsou nijak napadeny ani poškozeny. [3]
Samotný kontakt antigen prezentující buňky s lymfocytem ale není dostatečný signál pro zahájení imunitní reakce. Pro kompletní aktivaci a zahájení proliferace je nutno několik sekundárních signálů. Na rozdíl od pomocných T lymfocytů není pro cytotoxické T lymfocyty natolik zásadní protein CD28, ale potřebují zejména signály od dalších kostimulačních molekul, jako je CD70 a CD137 (4-1BB). Pokud je afinita T buňky k antigenu dostatečně silná, T lymfocyt dostane pozitivní signál několika dalších molekul, jako je ICOS, OX40 a víše zmíněné CD137.
Tyto molekuly se nachází na membráně T lymfocytu a jsou stimulovány odpovídajícími ligandy, typicky se vyskytujícími na membránách APC. Na rozdíl od proteinů CD28 a TCR se molekuly ICOS, CD137 a OX40 nevyskytují na membráně lymfocytu neustále, ale jen při kontaktu s afinním antigenem. Ani antigen prezentující buňky neprodukují odpovídající ligandy neustále, ale jen při nalezení antigenu.
Tato mechanika je důležitá, protože zajišťuje, že se T lymfocyt může zaktivovat pouze v přítomnosti buněk, které nějaký antigen opravdu našly a aktivně ho prezentují. Pokud se zaktivuje bez této kostimulační zpětné reakce, může dojít k funkčnímu útlumu (tzv. anergie), nebo dokonce buněčné smrti, aby lymfocyt nemohl zahájit nevhodnou, potenciálně autoimunitní odpověď.
Aby byly vytvořeny paměťové buňky, které umožňují opakovanou stimulaci cytotoxických T lymfocytů, musí dendritické buňky interagovat s CD4+ i CD8+ lymfocyty. [4] Během tohoto procesu získají dendritické buňky stimulaci ze strany CD4+ lymfocytů, následkem čehož mohou potentněji aktivovat CD8+ lymfocyty.[5]
Maturace CD8+ lymfocytů je dále zprostředkována signalizačními molekulami CD40. Jakmile se naivní CD8+ lymfocyt naváže na infikovanou buňku, napadená buňka je stimulována k vypuštění CD40 molekul, jenž s podporou CD4+ lymfocytů pomáhají s diferenciací cytotoxických T buněk.[6]
Přestože ve většině případů je aktivace lymfocytu závislá na rekognici antigenu molekulou TCR, byly popsány i alternativní způsoby aktivace. U některých CD8+ lymfocytů byla například pozorována aktivace poté, co byli účelně cíleny jinými CD8+ buňkami.[7]
Jakmile je lymfocyt definitivně zaktivován, projde klonální expanzí za účasti cytokinu IL-2, což je růstový a diferenciační faktor pro T lymfocyty. Tímto se zvýší počet buněk specifických vůči danému antigenu, ty pak následně putují tělem a vyhledávají antigen-pozitivní somatické buňky.
Efektorové funkce
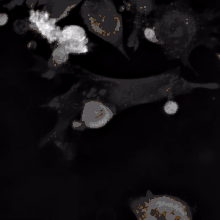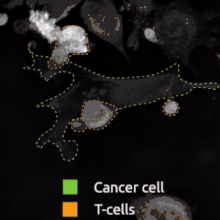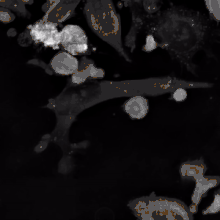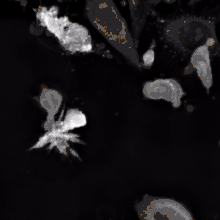
Když je lymfocyt vystaven infikované nebo jinak poškozené buňce prezentující odpovídající antigen na MHC1, vypustí několik cytotoxinů – perforin, granzymy a granulysin. Perforiny penetrují membránu cílové buňky, díky čemuž mohou do její cytoplazmy proniknout granzymy, které zde následně spouštějí kaspázovou kaskádu, což je série několika procesů vedoucí k apoptóze. Tento jev se označuje jako programovaná buněčná smrt. Samotné T lymfocyty jsou vůči vlastním perforinům rezistentní díky vysoce organizovaným lipidům a záporně nabytým fosfatidylserinům v jejich plazmatických membránách.[8]
Druhý způsob, jakým může u cílové buňky být spuštěna apoptóza je skrze kontakt povrchů lymfocytu a buňky. Aktivovaný CD8+ lymfocyt exprimuje na své membráně protein Fas ligand (FasL)(Apo1L)(CD95L), které se mohou vázat na Fas (Apo1)(CD95) molekuly exprimované na cílové buňce. Nicméně tato Fas-Fas ligandová interakce je pravděpodobně důležitější spíše pro zbavování se vyřazených T lymfocytů během jejich vývoje v brzlíku nebo pro lytickou aktivitě některých helper T cells, než pro cytolytickou aktivitu cytotoxických lymfocytů. Kontakt Fas s FasL umožňuje interakci s multiproteinovým komplexem DISC, umožňujícím aktivaci prokaspáz 8 a 10.[9] Ty dále aktivují efektorové kaspázy 3,6 a 7, vedoucí k nástupu substrátů jako je lamin A, lamin B1, lamin B2, PARP a DNA-PKcs. Výsledkem tohoto procesu je apoptóza buňky, která exprimovala Fas.
Předpokládá se, že transkripční faktor Eomesodermin hraje klíčovou roli ve funkci CD8+ buněk, regulující adaptivní imunitní odpověď. Studie, které se zabývali vlivem ztráty funkce Eomesoderminu zjistili, že se snížení množství tohoto transkripčního faktoru klesá i množství perforinu produkovaného CD8+ buňkami.[10]
Role v patogenezi
Na rozdíl od protilátek, které jsou efektivní vůči virovým i bakteriální onemocněním se cytotoxické T lymfocyty uplatňují především v boji s viry.[11]
Během onemocnění žloutenkou typu B (HBV) cytotoxické T lymfocyty zabíjejí infikované buňky a produkují cytokiny schopné zásadně poškodit i zdravé hepatocyty. Tato imunitní reakce hraje významnou roli v průběhu onemocnění a pravděpodobně zodpovídá za většinu následků spojovaných s infekcí žloutenky typu B.[12] Krevní destičky jsou spojovány s kumulací cytotoxických T lymfocytů v infikovaných játrech.[13]
Předpokládá se, že cytotoxické T lymfocyty hrají roli v progresi artritidy: zmenšování počtu důležitých molekul kolenních chrupavek, jako jsou mukopolysacharidy, vlivem cytotoxických lymfocytů a makrofágů byla pozorována na myším modelu.[14]
CD8+ T buňky hrají roli při HIV infekci. HIV se v průběhu času velmi dobře adaptovalo na imunitní systém svého hostitele. Například vysoká míra mutací viru umožňuje uniknout poznávacím mechanismům CD8+ buněk. Vir také dokáže hostitelskou buňku přimět ke snížení množství exprimovaných MHC1 na povrchu membrány, což zneschopňuje CD8+ lymfocytům efektivní rozpoznání a likvidaci nakažených buněk.[15]
Dále se ukazuje, že CD8+ lymfocyty mohou být zapojeny do onemocnění cukrovky typu 1. Studie na diabetických myších ukazují, že CD8+ lymfocyty by mohli hrát v onemocnění cílením a likvidací insulin-produkujících slinivkových buněk.[16]
CD8+ T buňky jsou pravděpodobně nezbytné pro předcházení a léčbu CIPN, což je vedlejší efekt způsobený chemoterapeutickými léky, poškozující nervový systém.[17][18] Bylo zjištěno, že myši bez CD8+ buněk mají delší CIPN v porovnání se standardními myšmi a vpíchnutí CD8+ buněk pomáhá řešit nebo dokonce předchází CIPN.
Odkazy
Reference
- Identical mice, different gut bacteria, different levels of cancer. medicalxpress.com [online]. [cit. 2021-05-09]. Dostupné online. (anglicky)
- T-cell development in thymus | British Society for Immunology. www.immunology.org [online]. [cit. 2021-05-09]. Dostupné online. (anglicky)
- GAUDINO, Stephen J.; KUMAR, Pawan. Cross-Talk Between Antigen Presenting Cells and T Cells Impacts Intestinal Homeostasis, Bacterial Infections, and Tumorigenesis. Frontiers in Immunology. 2019, roč. 10. Dostupné online [cit. 2021-05-09]. ISSN 1664-3224. DOI 10.3389/fimmu.2019.00360. (English)
- HOYER, Stefanie; PROMMERSBERGER, Sabrina; PFEIFFER, Isabell A. Concurrent interaction of DCs with CD4+ and CD8+ T cells improves secondary CTL expansion: It takes three to tango. European Journal of Immunology. 2014, roč. 44, čís. 12, s. 3543–3559. Dostupné online [cit. 2021-05-09]. ISSN 1521-4141. DOI 10.1002/eji.201444477. (anglicky)
- LANZAVECCHIA, Antonio. Licence to kill. Nature. 1998-06-XX, roč. 393, čís. 6684, s. 413–414. Dostupné online [cit. 2021-05-09]. ISSN 1476-4687. DOI 10.1038/30845. (anglicky)
- BENNETT, Sally R. M.; CARBONE, Francis R.; KARAMALIS, Freda. Help for cytotoxic-T-cell responses is mediated by CD40 signalling. Nature. 1998-06-01, roč. 393, s. 478–480. Dostupné online [cit. 2021-05-09]. ISSN 0028-0836. DOI 10.1038/30996.
- MILSTEIN, Oren; HAGIN, David; LASK, Assaf. CTLs respond with activation and granule secretion when serving as targets for T-cell recognition. Blood. 2011-01-20, roč. 117, čís. 3, s. 1042–1052. PMID: 21045195 PMCID: PMC3035066. Dostupné online [cit. 2021-05-09]. ISSN 0006-4971. DOI 10.1182/blood-2010-05-283770. PMID 21045195.
- RUDD-SCHMIDT, Jesse A.; HODEL, Adrian W.; NOORI, Tahereh. Lipid order and charge protect killer T cells from accidental death. Nature Communications. 2019-11-27, roč. 10. PMID: 31776337 PMCID: PMC6881447. Dostupné online [cit. 2021-05-09]. ISSN 2041-1723. DOI 10.1038/s41467-019-13385-x. PMID 31776337.
- BAKSHI, Rakesh K.; COX, Maureen A.; ZAJAC, Allan J. Cytotoxic T Lymphocytes. Příprava vydání Ian R. Mackay, Noel R. Rose, Betty Diamond, Anne Davidson. New York, NY: Springer Dostupné online. ISBN 978-0-387-84828-0. DOI 10.1007/978-0-387-84828-0_36. S. 332–342. (anglicky) DOI: 10.1007/978-0-387-84828-0_36.
- PEARCE, Erika L.; MULLEN, Alan C.; MARTINS, Gislâine A. Control of Effector CD8+ T Cell Function by the Transcription Factor Eomesodermin. Science. 2003-11-07, roč. 302, čís. 5647, s. 1041–1043. PMID: 14605368. Dostupné online [cit. 2021-05-09]. ISSN 0036-8075. DOI 10.1126/science.1090148. PMID 14605368. (anglicky)
- KEMBALL, Christopher C; ALIREZAEI, Mehrdad; WHITTON, J Lindsay. Type B coxsackieviruses and their interactions with the innate and adaptive immune systems. Future microbiology. 2010-9, roč. 5, čís. 9, s. 1329–1347. PMID: 20860480 PMCID: PMC3045535. Dostupné online [cit. 2021-05-09]. ISSN 1746-0913. DOI 10.2217/fmb.10.101. PMID 20860480.
- IANNACONE, Matteo; SITIA, Giovanni; GUIDOTTI, Luca G. Pathogenetic and antiviral immune responses against hepatitis B virus. Future Virology. 2006-03-01, roč. 1, čís. 2, s. 189–196. Dostupné online [cit. 2021-05-09]. ISSN 1746-0794. DOI 10.2217/17460794.1.2.189.
- IANNACONE, Matteo; SITIA, Giovanni; ISOGAWA, Masanori. Platelets mediate cytotoxic T lymphocyte–induced liver damage. Nature medicine. 2005-11, roč. 11, čís. 11, s. 1167–1169. PMID: 16258538 PMCID: PMC2908083. Dostupné online [cit. 2021-05-09]. ISSN 1078-8956. DOI 10.1038/nm1317. PMID 16258538.
- Asian journal of microbiology, biotechnology & environmental sciences: AJMBES.. Asian journal of microbiology, biotechnology & environmental sciences : AJMBES.. 1999. OCLC: 750766906. Dostupné online [cit. 2021-05-09]. ISSN 0972-3005. (English)
- NAVEED, Gulzar; KAREN, F. T. Copeland. CD8+ T-Cells: Function and Response to HIV Infection. Current HIV Research [online]. 2003-12-31 [cit. 2021-05-09]. Dostupné online. (anglicky)
- Chapter 4 CD8+ T Cells in Type 1 Diabetes. Advances in Immunology. 2008-01-01, roč. 100, s. 79–124. Dostupné online [cit. 2021-05-09]. ISSN 0065-2776. DOI 10.1016/S0065-2776(08)00804-3. (anglicky)
- LAUMET, Geoffroy; EDRALIN, Jules D.; DANTZER, Robert. Cisplatin educates CD8+ T cells to prevent and resolve chemotherapy-induced peripheral neuropathy in mice. Pain. 2019-6, roč. 160, čís. 6, s. 1459–1468. PMID: 30720585 PMCID: PMC6527475. Dostupné online [cit. 2021-05-09]. ISSN 0304-3959. DOI 10.1097/j.pain.0000000000001512. PMID 30720585.
- KRUKOWSKI, Karen; EIJKELKAMP, Niels; LAUMET, Geoffroy. CD8+ T Cells and Endogenous IL-10 Are Required for Resolution of Chemotherapy-Induced Neuropathic Pain. Journal of Neuroscience. 2016-10-26, roč. 36, čís. 43, s. 11074–11083. PMID: 27798187. Dostupné online [cit. 2021-05-09]. ISSN 0270-6474. DOI 10.1523/JNEUROSCI.3708-15.2016. PMID 27798187. (anglicky)