Clausův proces
Clausův proces je v současnosti nejpoužívanějším postupem pro odsíření ropy a zemního plynu a současně hlavním průmyslovým procesem výroby síry. Elementární síra se při něm získává spalováním sulfanu na oxid siřičitý a následnou katalytickou reakcí oxidu siřičitého se zbylým sulfanem. Proces patentoval německý chemik Carl Friedrich Claus v roce 1883 a postupem času se stal průmyslovým standardem.

Sulfan vzniklý například hydrodesulfurací rafinérských produktů je v Clausových jednotkách přeměněn na síru.[1] Tato reakce probíhá ve dvou krocích:
- 2 H2S +3 O2 → 2 SO2 + 2 H2O
- 2 H2S +SO2 → 3/2 S2 + 2 H2O
Naprostá většina ze světové roční produkce 64 milionů tun síry v roce 2005 vznikla jako vedlejší produkt rafinérií a jiných závodů na zpracování uhlovodíků.[2][3][4] Síra se používá na výrobu kyseliny sírové nebo pro výrobu léčiv, kosmetiky, hnojiv a gumárenských produktů. Elementární síra se používá jako hnojivo a pesticid.
Historie
Proces objevil Carl Friedrich Claus, německý chemik pracující v Anglii. Roku 1883 na svůj postup získal britský patent. Proces byl později značně modifikován německým koncernem IG Farben.[5] V současnosti se také využívají dále modifikované varianty s vyšším stupněm konverze (SuperClaus, EuroClaus atd.)
Popis procesu
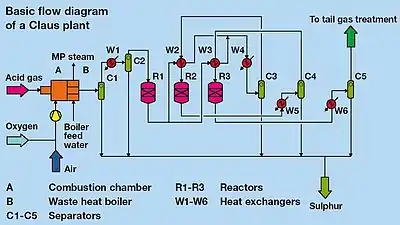
Rafinací zemního plynu a ropy se vzniká odpadní kyselý plyn, obsahující oxid uhličitý, sulfan a malé množství uhlovodíků.
Plyny s obsahem H2S vyšším než 25 % mohou být Clausovým procesem zpracovány přímo, v případě nižších vstupních koncentrací se používá upravený proces (předehřev plynů, rozdělení toků atd.).[6]
Clausův proces lze rozdělit do dvou hlavních fází: termické a katalytické.
Termická fáze
Během termické fáze se plyn obsahující sulfan spaluje s nižším než stechiometrickým množstvím vzduchu za teplot nad 850 °C[7], a následně elementární síra kondenzuje v navazujícím chladiči procesního plynu.
Obsah H2S a koncentrace dalších hořlavých složek (uhlovodíky nebo amoniak) určují místo, kde dochází k hoření vstupního plynu. Kyselé plyny bez jiných hořlavých komponent kromě H2S jsou spalovány odděleně od centrální komory pece podle následující chemické reakce:
- 2 H2S + 3 O2 → 2 SO2 + 2 H2O (ΔH = -518 kJ.mol−1)
Jedná se o silně exotermní totální oxidaci sulfanu za vzniku oxidu siřičitého, který je dále zreagován v následujících reakcích. Nejdůležitější z nich je Clausova reakce:
- 2 H2S + SO2 → 3 S + 2 H2O
Celková reakce je:[4]
- 8 H2S + 5 O2 → SO2 + 7/2 S2 + 8 H2O
Tato rovnice ukazuje, že v samotné termické fázi dochází ke konverzi dvou třetin sulfanu na síru.
Plyny s obsahem amoniaku se spalují v centrální komoře pece. Do komory je vháněno množství vzduchu dostatečné na to, aby došlo ke kompletnímu spálení všech uhlovodíků a amoniaku. Objemový poměr vzduchu a kyselého plynu se udržuje tak, aby celkově 1/3 všeho sulfanu (H2S) zkonvertovala na SO2. Tím je zajištěno dosažení stechiometrického poměru pro Clausovu reakci v následující katalytické fázi.
Oddělení spalovacích procesů zajišťuje dodržení přesných potřebných množství vzduchu pro jednotlivé procesy v závislosti na složení vstupního plynu. Kvůli snížení objemu procesního plynu nebo dosažení vyšších spalovacích teplot se někdy do komory dávkuje čistý kyslík. V průmyslové praxi se využívá několika technologií využívajících kyslíkové nízko- nebo vysokoobohacování spalovacího vzduchu, pro které jsou také konstruovány speciální hořáky.
Běžně v termické fázi dochází k přeměně 60 až 70 % celkového množství sulfanu na síru.
Hlavní část horkých plynů vycházejících ze spalovací komory proudí přes chladič procesního plynu a ochladí se natolik, aby obsažená síra zkondenzovala. Teplo předané ochlazením procesního plynu a kondenzační teplo slouží k výrobě středo- nebo nízkotlaké páry. Zkondenzovaná síra je odváděna z chladiče.
Síra v termické fázi tvoří vysoce reaktivní diradikály S2, které se slučují na alotrop S8
- 4 S2 → S8
Vedlejší reakce
Během termálního kroku Clausovy reakce dochází k těmto dalším reakcím:[4]
- Tvorba vodíkového plynu:
- 2 H2S → S2 + 2 H2 (ΔH > 0)
- CH4 + 2 H2O → CO2 + 4 H2
- Tvorba karbonylsulfidu:
- H2S + CO2 → S=C=O + H2O
- Tvorba sirouhlíku:
- CH4 + 2 S2 → S=C=S + 2 H2S
Katalytický krok
Clausova reakce pokračuje katalytickou fází s aktivovaným oxidem hlinitým nebo oxidem titaničitým, která dále zvyšuje výnos síry. Další sulfan (H2S) reaguje s oxidem siřičitým (SO2), vytvořeným spalováním v peci podle Clausovy reakce, a vzniká další plynná elementární síra.
- 2 H2S + SO2 → 3 S + 2 H2O (ΔH = -1165,6 kJ.mol−1)
Jeden z uvažovaných mechanismů uvádí, že S(6) a S(8) desorbují z aktivní vrstvy katalyzátoru se současnou tvorbou stabilní cyklické elementární síry.[8]
Katalytické získávání síry sestává z tří kroků: ohřev, katalytická reakce a chlazení s kondenzací. Tyto tři kroky jsou normálně opakovány maximálně třikrát.
Prvním krokem v katalytické fázi je ohřev plynu. Tím se zabrání kondenzaci síry na katalytickém loži a tím jeho zanesení a znehodnocení. Požadované provozní teploty každého jednotlivého katalytické stupně se dosáhne ohřevem plynu v přehřívačích (reheater).
V průmyslové praxi se užívá několika metod opětovného ohřevu:
- Obtok horkého plynu: míchá se dohromady proud ochlazeného plynu z chladiče a obtok horkého plynu z kotle na odpadní teplo.
- Nepřímý ohřev parou: plyn se dohřívá v parou vytápěném výměníku
- Výměník plyn/plyn: proud ochlazeného plynu z chladiče se ve výměníku ohřívá proudem horkého plynu z navazujícího katalytického reaktoru.
- Procesní pec: spalování kyselého nebo topného plynu s podstechiometrickým objemem kyslíku, aby nedošlo k úniku kyslíku, který by mohl poškodit katalyzátor.
Běžně doporučovaná provozní teplota prvního katalytického stupně je 315 °C až 330 °C (teplota katalytického lože). Tato vysoká teplota v prvním stupni také napomáhá hydrolyzovat karbonylsulfid (COS) a sirouhlík (CS2), které vznikají v peci a nelze je v Clausově procesu jinak odstranit.
Účinnost katalytické konverze roste s klesající teplotou, je však nutné zabezpečit, aby pracovní teplota v každém stupni byla nad teplotou rosného bodu síry. Běžné provozní teploty navazujících katalytických stupňů jsou 240 °C pro druhý stupeň a 200 °C pro třetí stupeň.
Proud procesního plynu z katalytických reaktorů se v navazujícím kondenzátoru zchladí na asi 150–130 °C. Kondenzační teplo je využito na výrobu páry v plášťovém prostoru kondenzátoru.
Proudy zkapalněné síry z chladičů, kondenzátorů a koncového separátoru jsou odvedeny do odplynovací jednotky, kde se odstraní plyny rozpuštěné v síře, především H2S.
Zbytkový plyn (tail gas) z Clausova procesu stále obsahuje hořlavé složky a sirné sloučeniny (H2S, H2 a CO). Je buď spálen nebo dále odsířen v jednotce čištění zbytkových plynů.
Clausův proces s teplotou síry pod rosným bodem
Konvenční Clausův proces popsaný výše má omezení konverze kvůli dosažení reakční rovnováhy. Jako u všech exotermních reakcí, vyšší stupeň konverze lze dosáhnout snížením reakční teploty. Clausův reaktor však musí pracovat při teplotě vyšší než je rosný bod síry (120–150 °C) aby nedošlo k zanesení katalyzátoru zkapalněnou sírou. Řešením tohoto problému je paralelní zapojení dvou reaktorů, kde jeden je provozní a druhý rezervní. Jakmile se první reaktor nasytí adsorbovanou sírou, přepne se vstupní proud do rezervního reaktoru. První reaktor se následně regeneruje proudem procesního plynu předehřátého na 300–350 °C, který odpaří síru. Tento proud se odvádí do kondenzátoru, kde se síra odloučí.
Bilance procesu
Na každou tunu získané síry je vyrobeno 2,6 tuny páry.
Fyzikální vlastnosti elementární síry vyrobené Clausovým procesem se mohou lišit od vlastností síry získané využitím jiných postupů.[4] Síra se obvykle převáží v kapalném stavu (bod tání je 115 °C). U elementární síry se její viskozita rychle zvyšuje při překročení teploty 160 °C kvůli formování polymerních řetězců. Další anomálií je klesající rozpustnost zbytkového H2S v kapalné síře s její klesající teplotou. To znamená, že jedovatý a výbušný sulfanový plyn se může hromadit v horní části zásobníku kapalné síry, kde dochází k jejímu chladnutí. Vysvětlením této anomálie je endotermní reakce síry se sulfanem na polysulfan.
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Claus process na anglické Wikipedii.
- Gary, J.H.; HANDWERK, G.E. Petroleum Refining Technology and Economics. 2nd. vyd. [s.l.]: Marcel Dekker, Inc., 1984. ISBN 0-8247-7150-8. (anglicky)
- Sulfur production report by the United States Geological Survey
- Discussion of recovered byproduct sulfur
- Der Claus-Prozess. Reich an Jahren und bedeutender denn je, Bernhard Schreiner, Chemie in Unserer Zeit 2008, Vol. 42, Issue 6, Pages 378-392.
- Bibliographic Citation Sulfur Recovery Technology, B.G. Goar, American Institute of Chemical Engineers Spring National Meeting, New Orleans, Louisiana, April 6, 1986
- Gas Processors Association Data Book, 10th Edition, Volume II, Section 22
- Nebo mezi 950 až 1200 °C a ještě více blízko plamene, jak je uvedeno v publikaci Der Claus-Prozess. Reich an Jahren und bedeutender denn je, Bernhard Schreiner, Chemie in Unserer Zeit 2008, Vol. 42, Issue 6, str. 378-392.
- KHANMAMEDOX, T. K.; WELLAND, R. H. How Sulphur Really Forms on The Catalyst Surface. Sulphur. BCInsight, 2013, s. 62. Dostupné online [cit. 01-02-2017]. (anglicky) Archivovaná kopie. www.ogtrt.com [online]. [cit. 2017-02-01]. Dostupné v archivu pořízeném z originálu.