Choleratoxín
Choleratoxín je 87 kDa proteín[1] produkovaný baktériou Vibrio cholerae, ktorá je extracelulárnym patogénom. Skladá sa z podjednotiek A a B: A podjednotka, ktorá má enzymatickú aktivitu; B podjednotka sa viaže na receptor na cytoplazmatickej membráne. Pomer podjednotiek je AB5. Päť B podjednotiek vytvára pentamérny kruh, ktorý obklopuje jednu A podjednotku, ktorá je umiestnená v centre kruhu. Ešte v intestinálnom trakte sú A podjednotky rozštiepené na A1 a A2 reťazce, pričom ale zostávajú kovalentne prepojené jednou disulfidovou väzbou, až kým nedosiahnu endoplazmatické retikulum.[2]
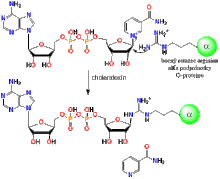
Po väzbe na lipidový receptor (gangliozid GM1) dôjde ku endocytóze komplexu choleratoxín-receptor, čím sa tento proteín ocitne v endocytotickej vezikule, ktorá splynie s endozómom, ktorý splynie s membránou Golgiho aparátu a z lumena GA sa choleratoxín dostane retrográdne do endoplazmatického retikula. Tam dochádza pomocou PDI (protein disulfide isomerase) ku:
- redukcii disulfidovej väzby medzi A1 a A2 reťazcom (PDI ako oxidoreduktáza)
- uvoľnenie A1 reťazca z holotoxínu
- „rozbalenie“ do nezloženej konformácie (PDI ako chaperón)
V membráne ER sa nachádzajú proteín-translokačné kanály (napr. SEC61), ktoré umožnia presun reťazca A1 lumena ER do cytoplazmy v nezbalenom stave. Po dosiahnutí cytozolu, A1 reťazec podľahne foldingu na zabránenie okamžitej degradácie v proteazóme.[3]
Podjednotka A cestuje k cytoplazmatickej membráne, kde enzymaticky pôsobí na α-podjednotku stimulačného G proteínu (GS), ktorú kovalentne a ireverzibilne modifikuje ADP-ribozyláciou arginínového zvyšku α-podjednotky. Ide o prenos ADP-ribózovej časti z NAD+ za uvoľnenia nikotínamidu. ADP-ribozyláciou mechanizmom SN1 vzniká N-glykozidová väzba.
Dôsledkom tejto kovalentnej modifikácie G-proteínu sa zablokuje GTPázová autokatalytická aktivita G proteínu a tým pádom sa G-proteín nemôže vrátiť do neaktívneho stavu. Aktívny G-proteín potom aktivuje adenylátcyklázu, ktorá začne produkovať cAMP, ktorý alostericky aktivuje cAMP-dependentnú proteinkinázu A (PKA), ktorá fosforyluje CFTR (cystic fibrosis transmembrane conductance regulator), čo je chloridový transportér, ktorý pumpuje chloridové anióny z cytozolu do extracelulárneho priestoru po aktivácii kovalentnou modifikáciou – fosforyláciou vykonanou proteínkinázou A (PKA). Na jeho aktivitu je potrebná ešte väzba ATP na nukleotidovú podjednotku. Spolu so chloridovými, sodnými, draselnými a hydrogenuhličitanovými aniónmi prechádza do lumena čreva voda, čo spôsobí prudké ťažké hnačky vedúce v priebehu niekoľkých hodín na smrť.[4]
Každý proteín v organizme má svoj polčas existencie, podobne aj GS proteíny a aj choleratoxín. Po eradikácii baktérie V. cholerae pôsobením antibiotík, nedochádza ku zaťažovaniu organizmu novými molekulami choleratoxínu. Po uplynutí určitého času dochádza ku degradácii choleratoxínu, čo spôsobí, že G-proteíny prestanú byť ADP-ribozylované, postupom času sa degradujú aj takto poškodené G-proteíny a sú nahradené novo nasyntetizovanými G-proteínmi (proteosyntéza G proteínov). Týmto mechanizmom sa človek vylieči z cholery.[5]
Referencie
- Molecular biology of the cell. New York : Garland Science, 2008. (5th ed.) Dostupné online. ISBN 978-0-8153-4105-5.
- KOOLMAN, Jan. Barevný atlas biochemie. Praha : Grada, 2012. (1. české vyd.) Dostupné online. ISBN 978-80-247-2977-0.
- VOET, Donald. Voet's principles of biochemistry. Hoboken, New Jersey : [s.n.], 2016. (Global edition.) Dostupné online. ISBN 978-1-119-45166-2.
- ALBERTS, Bruce. Molecular biology of the cell. New York, NY : [s.n.], 2015. (Sixth edition.) Dostupné online. ISBN 978-0-8153-4432-2.
- Harperova biochemie. Praha : H & H, 2002. (Vyd. v Česku 4., V H & H 3.) Dostupné online. ISBN 80-7319-013-3.