Aktivačná energia
Aktivačná energia (Ea - kJ.mol−1) je energia potrebná na to, aby sa pri vzájomnom stretnutí dvoch molekúl uskutočnila chemická reakcia. V jednoduchosti predstavuje aktivačná energia potenciálovú bariéru, ktorá oddeľuje dve minimá potenciálnej energie (energie reaktantov a produktov).
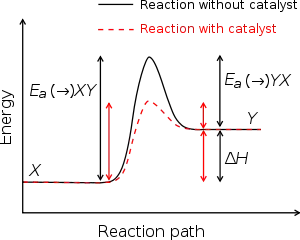
| Aktivačná energia (Ea) reakcie |
| Zníženie Ea pri použití katalyzátora |
Na to, aby reakcia prebehla sú potrebné nasledovné tri podmienky:
- molekuly sa musia zraziť
- je potrebná určitá energia, aby mohli molekuly spolu reagovať
- molekuly musia byť orientované „správnym“ smerom
Tieto faktory ovplyvňuje predovšetkým teplota, ktorá dodá molekulám kinetickú energiu, čím zvýši pravdepodobnosť zrážky. Matematický zápis aktivačnej energie predstavuje Arrheniova rovnica, ktorá objasňuje vzťah medzi aktivačnou energiou a reakčnými podmienkami. Jej zápis je nasledovný:
kde
- Ea - aktivačná energia
- R - univerzálna plynová konštanta
- T - termodynamická teplota
- k - zrážkový koeficient
- A - sterický faktor
| Chemický portál |
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.