Ubiquitin
Ubiquitin či ubikvitin (z lat. ubique, všude) je malý globulární polypeptid o délce 76 aminokyselin, přítomný ve všech eukaryotických buňkách, který reguluje rozklad jiných proteinů v proteazomu, lyzozomu či ve vakuole. V určitých případech však také stimuluje endocytózu, vnitrobuněčný transport a podílí se na udržování struktury chromatinu (ubiquitin se váže se na histony).[1]
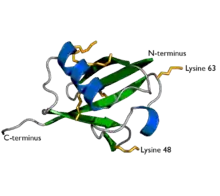
Ubiquitin se zpravidla připojí na protein, který má být rozložen (degradován), tento proces navázání ubiquitinu se označuje jako ubiquitinace. Váže se glycinem (na svém C-terminálním konci) k lysinu na proteinu určeném k degradaci.[1]
Po připojení ubiquitinu je označený protein degradován proteasomem 26S. Tato degradace je specifická a přesně cílená, je tedy často využívaná pro specifické odstranění proteinů signálních drah. Proteiny degradované proto, aby jejich aminokyseliny, případně peptidy mohly být použity jako stavební kameny, bývají degradovány spíše nespecificky proteázami.
Mechanismus připojení
Na cílový protein, určený k degradaci, se ubikvitin váže pomocí tří enzymů, aktivačního E1, konjugačního E2 a ligačního E3. Enzym E3 se označuje jako ubikvitin-ligáza. Ligační enzym se spojí s cílovým proteinem. Aktivační enzym nejprve ubikvitin aktivuje na účet ATP a poté ho předá konjugačnímu enzymu, který se spojí s komplexem, tvořeným ligačním enzymem spojeným s cílovým proteinem určeným k degradaci. V tomto komplexu tvořeným E2, E3, ubikvitinem a cílovým proteinem pak dojde k navázání ubikvitinu na cílový protein. E2 a E3 se recykluje.[2]
Reference
- ROBERT C. KING; WILLIAM D. STANSFIELD; PAMELA K. MULLIGAN. A Dictionary of Genetics, Seventh Edition. [s.l.]: Oxford University Press, 2006.
- ALBERTS, Bruce et al. Molecular Biology of the Cell. [s.l.]: Garland Science, 2002. Dostupné online.
Externí odkazy
 Obrázky, zvuky či videa k tématu ubiquitin na Wikimedia Commons
Obrázky, zvuky či videa k tématu ubiquitin na Wikimedia Commons