Kapilární elektroforéza s hmotnostní spektrometrií
Kapilární elektroforéza s hmotnostní spektrometrií (CE-MS) je metoda v analytické chemii, při které se složky směsi oddělují pomocí kapilární elektroforézy a hmotnostním spektrometrem.[1]
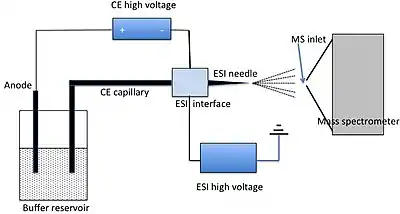
CE-MS spojuje výhody vyplývající z používání CE a MS a vyznačuje se vysokou účinností separace a velmi dobrým rozlišením molekulových hmotností získatelným během jediné analýzy.[2]
Kromě dobrého rozlišení a vysoké citlivosti se tato metoda vyznačuje minimálním objemem vzorku potřebným k analýze (řádově v nanolitrech) a rychlým provedením. Ionty se obvykle tvoří elektrosprejovou ionizací,[3] ovšem mohou být získány také pomocí matricí asistované laserové desorpce[4] i jiné postupy.
CE-MS se využívá v proteomice[5], při kvantitativní analýze biomolekul[6] a v klinické medicíně.[7][8] Od objevu v roce 1987 byla kapilární elektroforéza s hmotnostní spektrometrií vyvinuta do podoby široce použitelné separační a identifikační metody. K vyřešení potíží s ní souvisejících je však potřeba najít vhodné rozhraní, druh ionizace a hmotnostního detektoru.
Historie
První rozhraní mezi přístrojem pro kapilární elektroforézu a hmotnostním spektrometrem vyvinuli Richard D. Smith et al. v roce 1987.[9]
Aplikace vzorku
K aplikaci vzorku do CE-MS soustavy se používají dva způsoby, které jsou podobné jako u samotné kapilární elektroforézy: hydrodynamický a elektrokinetický.
Hydrodynamická aplikace
Při hydrodynamické aplikaci se nejprve umístí kapilára do malé nádobky. Následně lze hydrodynamickou aplikaci provést několika způsoby: pozitivním tlakem, negativním tlakem, nebo umístěním vstupu vzorku nad úroveň jeho výstupu z kapiláry.[10] Tímto způsobem lze aplikovat větší množství vzorku než u elektrokinetické aplikace a variační koeficient bývá obvykle pod 0,02. Objem a opakovatelnost vzorku jsou obvykle závislé na době jeho vstřikování, výškovém posunu vzorku a tlaku působícímu na vzorek.[11]
Jednou z hlavních výhod hydrodynamické aplikace je také to, že není ovlivňována rozdílnou elektroforetickou pohyblivostí různých molekul. Za účelem zvýšení propustnosti CE-MS analýzy byla vyvinuta hydrodynamická multisegmentová aplikace vzorku, při které je na separační kapiláru před analýzou hydrodynamicky naneseno několik vzorků a každý z nich je umístěn mezi elektrolytové rozpěrky.[12]
Elektrokinetická aplikace
Elektrokinetická aplikace vzorku pro CE-MS spočívá ve vysokém napětí, které je přivedeno na vzorek a ten se přesouvá do CE kapiláry elektromigrací a elektroosmotickým tokem.[13]
Při elektrokinetické aplikaci se citlivost, na rozdíl od hydrodynamické aplikace, zvyšuje s klesajícím napětím a prodlužujícím se časem nanášení, ovšem opakovatelnost a migrační časy jsou delší. Tuto metodu nelze použít u analytů s vysokou elektroforetickou pohyblivostí, která vede k lepšímu nanášení vzorků a elektrokinetická aplikace je tak citlivá na vlivy matrice a změny iontové síly ve vzorku.[14]
Druhy rozhraní
Kapilární elektroforéza využívá k oddělování iontů elektrické pole, které vytváří elektroosmotický tok. Analyty se přesunují z jednoho konce kapiláry na druhý na základě svého náboje, viskozity a velikosti molekul. Čím silnější je elektrické pole, tím větší je pohyblivost analytů.
Hmotnostní spektrometrie je analytická metoda, při níž se k identifikaci látek ve vzorku využívají rozdílné hodnoty poměru hmoty a náboje. Zdroj iontů mění molekuly přicházející z CE na ionty, které se pohybují v elektrickém a magnetickém poli. Oddělené ionty jsou poté měřeny pomocí detektoru.
Hlavními problémy při spojení kapilární elektroforézy a hmotnostní spektrometrie jsou nedostačující znalosti dějů probíhajících na rozhraní mezi CE a MS. Propojení lze dosáhnout pomocí několika ionizačních metod, jako jsou, ESI, MALDI, APCI a DESI. Nejčastěji se používá ESI.
Elektrosprejová ionizace
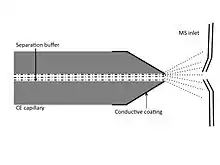
První používaný druh rozhraní u CE-MS obsahuje kapiláru z nerezové oceli, která obklopuje separační kapiláru a nahrazuje koncovou elektrodu obvykle používanou u CE.[15]
Elektrický kontakt tvořený nerezovou kapilárou společně s elektrolytem se nachází na místě, kde uzavírá okruh a iniciuje vznik elektrospreje. Nevýhodou tohoto rozhraní je například nesoulad v intenzitách toků obou systémů k dosažení spojitého toku a lepšího elektrického kontaktu bylo vyvinuto několik vylepšení. Pro dobré fungování CE-MS rozhraní je také důležité správně zvolit pufr, který musí být vhodný jak pro kapilární elektroforézu, tak i pro ESI.
Ostřelování rychlými atomy
CE lze propojit s ionizací ostřelováním rychlými atomy se spojitým tokem.[16] U rozhraní musí být sladěny rychlosti toků mezi oběma systémy. Ionizace rychlými atomy vyžaduje poměrně vysoké rychlosti, zatímco u kapilární elektroforézy musí být za účelem dosažení lepší separace nízké.
CE s MALDI-MS

Při spojení CE s MALDI může být eluent z CE rozprašován nebo po kapkách aplikován na MALDI destičku, následně vysušen a analyzován hmotnostním spektrometrem. Lze též použít pohyblivý terčík, který se neustále dotýká konce CE kapiláry. Terčík posbírá analyty pro MS, kde jsou desorbovány a ionizovány. Musyimi et al. vyvinuli jiný postup, kdy se k přenosu od CE k MS používá rotující koule.[17] Vzorek z CE se smísí s matricí přicházející jinou kapilárou. Rotací koule se vzorek vysuší předtím, než se dostane do ionizační komory. Tato metoda má vysokou citlivost.
Použití
Možnost oddělovat a analyzovat analyty přítomné ve velmi nízkých koncentracích s velkou přesností a v krátkém čase lze využít v různých vědních oborech. CE-MS se používá při analýzách biomolekul, léčiv a látek v životním prostředí a také ve forenzních vědách.[18][19] Největší využití má CE-MS v biologickém výzkumu při analýze bílkovin a peptidů. Také se jedná o častou metodu analýzy léčiv. Existuje několik studií popisujících charakterizaci směsí peptidů a bílkovin. Kapilární elektroforéza s hmotnostní spektroskopií může být použita na analýzu tělních tekutin za účelem hledání biomarkerů.[20]
Odkazy
Související články
Reference
V tomto článku byl použit překlad textu z článku Capillary electrophoresis–mass spectrometry na anglické Wikipedii.
- J. A. Loo; H. R. Udseth; R. D. Smith. Peptide and protein analysis by electrospray ionization-mass spectrometry and capillary electrophoresis-mass spectrometry. Analytical Biochemistry. 1989, s. 404–412. Dostupné online. DOI 10.1016/0003-2697(89)90153-X. PMID 2774189.
- Jianyi Cai; Jack Henion. Capillary electrophoresis-mass spectrometry. Journal of Chromatography A. 1995, s. 667–692. DOI 10.1016/0021-9673(94)01178-h.
- E. J. Maxwell; D. D. Chen. Twenty years of interface development for capillary electrophoresis-electrospray ionization-mass spectrometry. Analytica Chimica Acta. 2008, s. 25–33. DOI 10.1016/j.aca.2008.06.034. PMID 18790125.
- H. Zhang; R. M. Caprioli. Capillary electrophoresis combined with matrix-assisted laser desorption/ionization mass spectrometry; continuous sample deposition on a matrix-precoated membrane target. Journal of Mass Spectrometry. 1996, s. 1039–1046. DOI 10.1002/(SICI)1096-9888(199609)31:9<1039::AID-JMS398>3.0.CO;2-F. PMID 8831154. Bibcode 1996JMSp...31.1039Z.
- J. Metzger; J. P. Schanstra; H. Mischak. Capillary electrophoresis-mass spectrometry in urinary proteome analysis: current applications and future developments. Analytical and Bioanalytical Chemistry. 2008, s. 1431–1442. DOI 10.1007/s00216-008-2309-0. PMID 18704377.
- J. Ohnesorge; C. Neusüss; H. Wätzig. Quantitation in capillary electrophoresis-mass spectrometry. Electrophoresis. 2005, s. 3973–3987. DOI 10.1002/elps.200500398. PMID 16252322.
- W. Kolch; C. Neusüss; M. Pelzing; H. Mischak. Capillary electrophoresis-mass spectrometry as a powerful tool in clinical diagnosis and biomarker discovery. Mass Spectrometry Reviews. 2005, s. 959–977. DOI 10.1002/mas.20051. PMID 15747373. Bibcode 2005MSRv...24..959K.
- M. Dakna; Z. He; W. C. Yu; H. Mischak; W. Kolch. Technical, bioinformatical and statistical aspects of liquid chromatography-mass spectrometry (LC-MS) and capillary electrophoresis-mass spectrometry (CE-MS) based clinical proteomics: A critical assessment. Journal of Chromatography B. 2008, s. 1250–1258. DOI 10.1016/j.jchromb.2008.10.048. PMID 19010091.
- Schmitt-Kopplin, P., Frommberger, M.(2003).Capillary electrophoresis – mass spectrometry: 15 years of developments and applications. Electrophoresis, 24, 3837-3867
- M. C. Breadmore. Electrokinetic and hydrodynamic injection: Making the right choice for capillary electrophoresis. Bioanalysis. 2009, s. 889–894. DOI 10.4155/bio.09.73. PMID 21083060.
- SCHAEPER, J.P.; SEPANIAK, M. J. (2000). Parameters affecting reproducibility in capillary electrophoresis.. Electrophoresis. 2000, s. 1421–1429. DOI 10.1002/(SICI)1522-2683(20000401)21:7<1421::AID-ELPS1421>3.0.CO;2-7. PMID 10826690. (anglicky)
- N. L. Kuehnbaum; A. Kormendi; P. Britz-Mckibbin. Multisegment injection-capillary electrophoresis-mass spectrometry: A high-throughput platform for metabolomics with high data fidelity. Analytical Chemistry. 2013, s. 10 664 – 10 669. DOI 10.1021/ac403171u. PMID 24195601.
- M. C. Breadmore. Electrokinetic and hydrodynamic injection: Making the right choice for capillary electrophoresis. Bioanalysis. 2009, s. 889–894. DOI 10.4155/bio.09.73. PMID 21083060.
- SCHAEPER, J. P.; SEPANIAK, M. J. Parameters affecting reproducibility in capillary electrophoresis.. Electrophoresis. 2000, s. 1421–1429. DOI 10.1002/(SICI)1522-2683(20000401)21:7<1421::AID-ELPS1421>3.0.CO;2-7. PMID 10826690. (anglicky)
- J. A. Olivares; N. T. Nguyen; C. R. Yonker; R. D. Smith. On-line mass spectrometric detection for CZE. Analytical Chemistry. S. 1230–1232. DOI 10.1021/ac00135a034.
- Richard M. Caprioli; William T. Moore. Mass Spectrometry. [s.l.]: [s.n.], 1990. Dostupné online. ISBN 9780121820947. Kapitola [9] Continuous-flow fast atom bombardment mass spectrometry, s. 214-237.
- Musyimi H.K.; Narcisse D. A.; Zhang X.; Stryjewski, W.; Soper S. A.; Murray K. K. (2004) “Online CE-MALDI –TOF MS using a rotating ball interface.” Anal Chem 76:5968-5973
- R. Haselberg; V. Brinks; A. Hawe; G. J. Jong; G. W. Somsen; H. P. Zimmermann. Capillary electrophoresis-mass spectrometry using noncovalently coated capillaries for the analysis of biopharmaceuticals. Analytical and Bioanalytical Chemistry. 2011, s. 295–303. DOI 10.1007/s00216-011-4738-4. PMID 21318246.
- B. Wimmer; M. Pattky; L. G. Zada LG; M. Meixner; S. B. Haderlein; H. P. Zimmermann; C. Huhn. Capillary electrophoresis-mass spectrometry for the direct analysis of glyphosate: method development and application to beer beverages and environmental studies. Analytical and Bioanalytical Chemistry. 2020, s. 4967–4983. DOI 10.1007/s00216-020-02751-0. PMID 32524371.
- Mischak H.; Coon J.J.; Novak J.; Weissinger E. M.; Schanstra J.P.; Dominiczak A.F.Capillary electrophoresis-mass spectrometry as a powerful tool in biomarker discovery and clinical diagnosis: an update of recent developments. Mass Spec. Reviews 28 (2008)