Ionizace
Ionizace je proces, při kterém se z elektricky neutrálního atomu nebo molekuly stává iont. Pojem „ionizace“ také označuje stav hmoty, která obsahuje ionty.
Opačným dějem k ionizaci je rekombinace.
Popis procesu
Vznik záporných iontů, aniontů, je zpravidla způsoben dodáním záporného elektrického náboje - prostřednictvím jednoho nebo více elektronů - do elektronového obalu částice. Vznik kladných iontů, kationtů, je naopak podmíněn odtržením jednoho či více elektronů z elektronového obalu, k čemuž je potřeba částici dodat energii, nejčastěji ve formě dopadajícího elektromagnetického záření - fotonů.
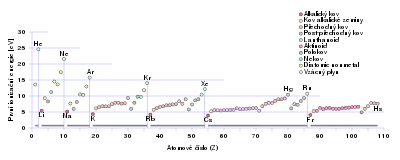
Minimální energie potřebná k odstranění jednoho elektronu se označuje jako ionizační potenciál (ionizační energie). Je to minimální energie, kterou musí mít dopadající částice, aby mohlo dojít k ionizaci a vytvoření kationtu. Ionizační potenciál se udává v elektronvoltech (1 eV = 1,6×10−19 J). Pro vodík má hodnotu 13,53 eV, kyslík 15,8 eV a rtuť 10,4 eV.
Přidáním elektronu k atomu určitého prvku dojde k uvolnění jisté energie, kterou označujeme jako elektronovou afinitu.
Tento proces funguje trochu odlišně v závislosti na tom, zda je iont vytvářen s kladně nebo záporně nabitým elektrickým nábojem. Kladně nabité ionty, jsou vytvářeny, když elektrony vázané na atom (nebo molekulu) absorbují dostatek energie k úniku z elektronového obalu. Množství energie potřebné k úniku se nazývá ionizační energie. Záporně nabité ionty vznikají, když se volný elektron srazí s atomem a následně se zachytí uvnitř elektronového obalu.
Obecně lze ionizace rozdělit do dvou typů: sekvenční ionizace a ne-sekvenční ionizace. V klasické fyzice může probíhat jen sekvenční ionizace (více informací v sekci Klasická ionizace). Ne-sekvenční ionizace porušuje několik zákonů klasické fyziky (najdete ji v sekci Kvantová ionizace).
Klasická ionizace
Vztahuje se pouze na klasickou fyziku a Bohrův model atomu, který dělá jak atomovou tak i molekulární ionizaci zcela deterministickou, což znamená, že každý problém má vždy určitou a vypočitatelnou odpověď. Podle klasické fyziky, je naprosto nezbytné, aby energie elektronu převyšovala energetický rozdíl elektronového obalu, kterým se snaží projít. Analogie pro lepší pochopení: Stejným způsobem nemůže člověk skočit přes zeď vysokou jeden metr, bez toho aby vyskočil jeden metr vysoko nad zem, elektron se nemůže dostat přes 13,6-eV elektronového obalu, bez méně jak 13,6 eV energie.
Aplikování pozitivní ionizace
Podle těchto dvou principů, energie potřebná k uvolnění elektronu je větší než nebo rovna rozdílu mezi současnou atomovou vazbou nebo molekulárním orbitalem a nejvyšším možným orbitalem. Pokud absorbovaná energie přesahuje tento potenciál, pak se elektron vydává jako volný elektron. V opačném případě elektron krátce vstoupí do excitovaného stavu, dokud není absorbovaná energie vyzářena a elektron znovu vstoupí do nejnižšího možného stavu.
Aplikování negativní ionizace
Vzhledem k tvaru potenciálové bariéry, podle těchto zásad, musí mít volný elektron energii vyšší nebo rovnu energii potenciálové bariéry, aby byl schopný se přes ni dostat. Pokud má volný elektron dostatek energie, aby tak učinil, přejde do nejnižšího možného energetického stavu a zbývající energie bude vyzářena pryč. Pokud elektron nemá dostatek energie k překonání potenciálové bariéry, pak je elektrostatickou silou zahnán zpět, což je popsáno v Coulombově zákoně.
Sekvenční ionizace
Sekvenční ionizace je popis toho, jak probíhá ionizace atomu nebo molekuly. Například, iont s +2 nábojem může být vytvořen pouze z iontů s +1 nábojem nebo +3 nábojem. To znamená, že numerické náboj atomu nebo molekuly se musí měnit postupně, vždy se mění z čísla na číslo předchozí nebo následující.
Kvantová ionizace
V kvantové mechanice, může ionizace probíhat klasicky, kdy elektron má dost energie k překonání potenciálové bariéry, ale je zde další možnost tunelové ionizace.
Tunel ionizace
Tunel ionizace probíhá důsledkem ionizace kvantového tunelování. V klasické ionizaci, musí mít elektron dostatek energie k překonání potenciálové bariéry, ale kvantové tunelování dovoluje elektronu jednoduše projít přes potenciálovou barieru díky vlnovému charakteru elektronu. Pravděpodobnost průchodu elektronu přes bariéru exponenciálně klesá se šířkou potenciálové bariéry.
Ne-sekvenční ionizace
Pokud je střídavý proud kombinován s tunelem ionizace, dochází k hlavnímu jevu ne-sekvenční ionizace. Elektron, který se snaží dostat z atomu nebo molekuly může být zaslán zpátky vlivem střídavého proudu, přičemž nemůže být znovu zkombinován s atomem nebo molekulou a nemůže dojít k uvolnění přebytečné energie. Nebo má atom nebo molekula možnost dále ionizovat, díky vysokoenergetickým srážkám. Tato dodatečná ionizace je označována jako ne-sekvenční ionizace ze dvou důvodů: Za prvé, není zde žádné pravidlo toho, jak je druhý elektron odstraněn, a druhé, atom nebo molekula s +2 nábojem může být vytvořena přímo z atomu nebo molekuly s neutrálním nábojem, takže čísla nábojů nejsou sekvenční. Ne-sekvenční ionizace je často zkoumána na laserovém poli o nižší intenzitě, neboť při vysoké míře ionizace je většina ionizačních události sekvenční.
Příklad
Vzduch je vždy alespoň částečně ionizován účinkem kosmického záření a radioaktivitou zemské kůry. Běžně vzniká v 1 cm3 vzduchu každou sekundu přibližně deset kladných iontů a elektronů. Elektrony se poté mohou spojit s neutrální molekulou a vytvořit záporný iont. Obecně ionizace plynu se uskutečňuje např. el. výbojem, vysokou teplotou či srážkami molekul s velkou kinetickou energii
- Fotoionizace - vznik iontů absorpcí ultrafialového, rentgenového či ʏ-záření
- Násobná ionizace - odtržení více než jednoho elektronu od neutrální molekuly (atomu)
Použitá literatura
- Malá encyklopedie chemie, Praha 1976