Daltonův zákon parciálních tlaků
Daltonův zákon pojmenovaný po svém objeviteli Johnu Daltonovi zní:
- Tlak směsi plynů je roven součtu jejich parciálních tlaků.
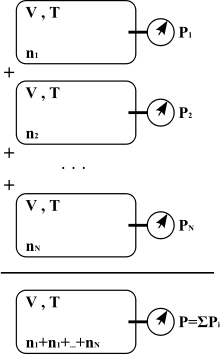
Daltonův zákon parciálních tlaků
Vyjádřeno matematicky, celkový tlak P směsi n plynů můžeme definovat jako součet parciálních tlaků jednotlivých plynů obsažených ve směsi
kde představují parciální tlak (= částečný tlak) každého z plynů přítomných ve směsi.
Platnost
Zákon přesně platí pro ideální plyny. Pro reálné plyny je, zejména pro vyšší tlaky, narušen kvůli objemu obsazenému molekulami a mezimolekulovému silovému působení.
Daltonův zákon parciálních tlaků, stejně jako obdobný Amagatův zákon parciálních objemů neplatí ani při prudkých lokálních změnách tlaku, např. v rázové vlně.[1]
Reference
- DELKER, Kim. Study calls 200-year-old law about gas mixtures into question. Phys.Org, 9. prosinec 2019. Dostupné online (anglicky)
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.